STTT
时间:2024-05-06

Yes-associated protein(YAP)从细胞质向细胞核的转位是促进异常细胞生长和肿瘤发生的中心细胞事件。已经进行了大量研究以阐明调控YAP在细胞质中的封存和在细胞核中的保留的机制。在细胞质中,YAP与一组蛋白相互作用,包括14-3-3、AMOT、PTPN14和 -连环蛋白,它们负责将其封存在细胞质中。与之相反,YAP与其在细胞核中的伴侣直接结合,包括TEADs和MAML1/2,促进了YAP的细胞核保留,从而刺激了细胞增殖、存活和迁移,并推动了药物抵抗。
维持细胞质封存和细胞核保留之间的微妙平衡对于YAP的功能至关重要。此外,YAP含有一个常规的核出口信号,有助于其核出口。然而,与其果蝇同源基因Yorkie不同,尚未在哺乳动物YAP蛋白中鉴定出经典的核定位信号(NLS)。缺乏经典的NLS对于在哺乳动物细胞中调节YAP的核入的机制提出了一个有趣的问题。尽管施加到细胞核的力会通过减少核孔的机械限制而增加YAP的核入,但仍需要进一步的分子研究来解开YAP核入的机制及其在疾病发病机制中的潜在意义。
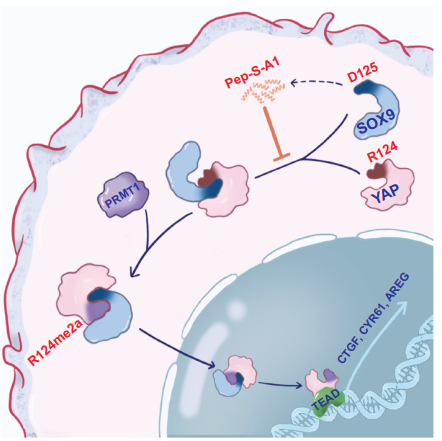
SRY相关高迁移率基因箱9(SOX9)作为转录因子,在各种生物学过程中发挥着关键作用,包括性、性别决定和祖细胞发育。SOX9已被广泛地表征为候选癌症干细胞标记物。SOX9在癌症发生、化疗抵抗和干细胞维持中的参与突显了其在肿瘤生物学中的关键调控功能。YAP和SOX9在许多肿瘤中被异常上调,它们作为驱动肿瘤进展的关键调节因子。YAP在几种肿瘤的发育过程中通过转录促进SOX9的表达,而SOX9在调节YAP活性方面的作用和机制尚存在争议。
已经证明,SOX9通过增加食管鳞状中YAP靶向microRNA的水平来抑制YAP的表达。最近的研究表明,SOX9可能会破坏肝细胞中YAP/TEAD之间的协同相互作用,并改变YAP靶向基因的响应元件。相反,已经发现SOX9增加了YAP的活性,并在中促进了上皮间质转化(EMT)。这一发现表明,SOX9可能会作为YAP活性的正调节因子,这取决于细胞微环境和肿瘤的异质性。此外,虽然YAP的动态活性取决于其相对水平的核入,但SOX9是否影响YAP的核转位尚未得到探讨。
后转录修饰(PTM)是参与YAP核浆分布的重要调节机制。丝氨酸-127的磷酸化是通过Hippo途径介导的,这是决定YAP亚细胞定位的关键因素。这个过程作为14-3-3蛋白的结合位点,导致YAP在细胞质中的封存和抑制其靶基因的活性。影响YAP亚细胞定位的另一种PTM是由SET1A介导的赖氨酸342(K342)的单甲基化。YAP的这种修饰阻碍了CRMX1介导的YAP的核出口,导致其在多种的细胞核中的积累。PRMT1是I型蛋白精氨酸甲基转移酶(PRMTs)家族的主要成员。PRMT1选择性地催化底物蛋白的精氨酸残基上的不对称二甲基化(Rme2a,也称为ADMA)修饰。先前的研究已经揭示,PRMT1在肿瘤细胞中表达异常,并且甲基化多种涉及癌症侵袭性、药物敏感性和预后判断的底物蛋白。最近,已经验证了PRMT1通过精氨酸甲基化影响p14(ARF)的亚细胞定位和周转。值得注意的是,已经报道在软标本中PRMT1水平升高与YAP的核积累呈正相关。然而,特定的YAP精氨酸甲基化是否负责其亚细胞定位尚未报道。