Nature:同时靶向PIKfyve和KRAS
时间:2025-04-27
来源:100医药网 2025-04-27 17:48
在这项新的研究中,研究人员专注于PIKfyve,这是一种酶,已被确定为其他癌症类型的溶酶体靶点,包括血液恶性肿瘤。是癌症相关死亡的主要原因,五年生存率为13%。高死亡率主要是由于缺乏有效的治疗选择。胰腺导管腺癌(PDAC)是癌症最常见的胰腺癌类型,由于细胞环境的原因,其治疗具有挑战性。
在一项新的研究中,来自密歇根大学的研究人员发现,同时靶向PIKfyve和KRAS-MAPK可以消除人类胰腺系和临床前小鼠模型中的胰腺肿瘤。相关研究结果发表在Nature杂志上。

论文共同通讯作者Costas Lyssiotis说, 胰腺肿瘤主要由非癌细胞组成。在一些患者中,这种肿瘤的10%才由恶性组成。尽管这些细胞由于功能失调而无法获得血液来源的营养,但它们通过开启不同的过程来生存。
这些过程包括循环途径、使用营养转运蛋白和逃避系统。作为负责分解和回收磨损的细胞器,溶酶体在帮助恶性肿瘤细胞茁壮成长方面发挥着关键作用。Lyssiotis说, 尽管溶酶体是一个有吸引力的靶点,但对于胰腺癌,没有药物对其有效。
在这项新的研究中,研究人员专注于PIKfyve,这是一种酶,已被确定为其他癌症类型的溶酶体靶点,包括血液恶性肿瘤。
论文第一作者Caleb Cheng说, 尽管PIKfyve抑制剂已经通过了其他癌症的1期临床试验,但尚不清楚它们如何减少肿瘤发展和生长,以及它们是否对胰腺癌有效。
通过使用基因工程小鼠模型,研究人员发现,与含有PIKfyve的小鼠相比,缺乏PIKfyive的小鼠患胰腺癌的程度较低。此外,用PIKfyve抑制剂apilimod和ESK981治疗的小鼠在10周后癌症生长较低。
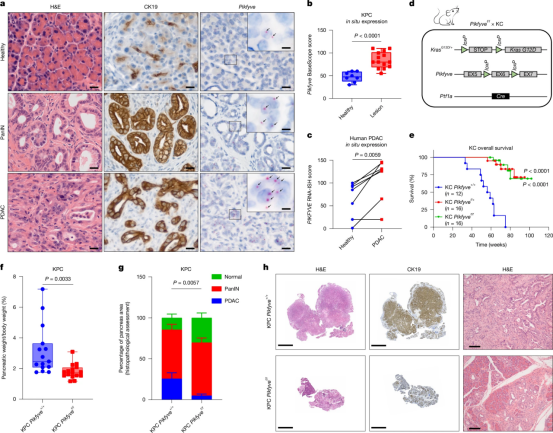
Pikfyve对于前体PanIN病变发展为PDAC至关重要
为了了解PIKfyve如何驱动胰腺癌细胞中的溶酶体过程,他们使用人类胰腺癌细胞系来确定哪些基因受到PIKfyve抑制剂的影响。
Cheng说, 溶酶体降解癌细胞中的分子,并利用由此产生的产物制造有用的蛋白或将其转化为能量。我们发现溶酶体需要PIKfyve来回收脂肪。如果我们抑制PIKfyfe,胰腺癌细胞如今就被迫制造自己的脂肪,相关基因也会被激活。
他们证明,胰腺肿瘤细胞通过KRAS-MAPK途径产生新的脂肪。Lyssiotis说, KRAS是胰腺癌的主要调节因子,目前正在进行新药临床试验,以降低这一主要因子。
尽管KRAS抑制剂的实施标志着该领域的一个重要里程碑,但用KRAS抑制剂治疗的癌细胞最终变得具有耐药性。这说明了组合治疗的必要性,这也进一步阐明了PIKfyve抑制剂的潜力。论文共同作者、密歇根大学转化病理学研究助理教授Yuanyuan Qiao说, 我们明确证明了PIKfyve基因在KRAS驱动的胰腺癌中的关键作用。
在几个最先进的临床前模型中,这种联合疗法(即同时靶向PIKfyve和KRAS-MAPK,比如同时使用PIKfyve抑制剂和KRAS抑制剂)完全治愈了胰腺癌小鼠。
论文共同通讯作者Arul Chinnaiyan说, 我们发现的最令人兴奋的方面是发现了一种新的策略,可以重新连接脂质代谢,并显著提高KRAS抑制剂在已被批准用于胰腺癌症治疗的药物中的疗效。 ( 100yiyao.com)
参考资料:
Caleb Cheng et al, , Nature (2025). DOI: 10.1038/s41586-025-08917-z.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
