Cell子刊:姜学军团队揭示缺氧通过表观遗传调控铁死亡
时间:2025-07-29
来源:生物世界 2025-07-29 09:29
该研究首次发现,缺氧通过抑制组蛋白去甲基化酶 KDM6A 活性,以缺氧诱导因子(HIF)非依赖的方式抑制铁死亡。铁死亡(Ferroptosis)是一种由铁依赖性磷脂过氧化驱动的代谢性细胞死亡过程,与包括癌症在内的多种病理状况有关。尽管诸如葡萄糖、脂质和多种氨基酸等代谢因素已被证实能够调控铁死亡,但作为另一个基本代谢成分的氧气在铁死亡中的作用,尚未被阐明。
2025 年 7 月 24日,纪念斯隆-凯特琳癌症中心姜学军教授团队在 Cell 子刊Molecular Cell上发表了题为:HIF-Independent Oxygen Sensing Via KDM6A Regulates Ferroptosis的研究论文。
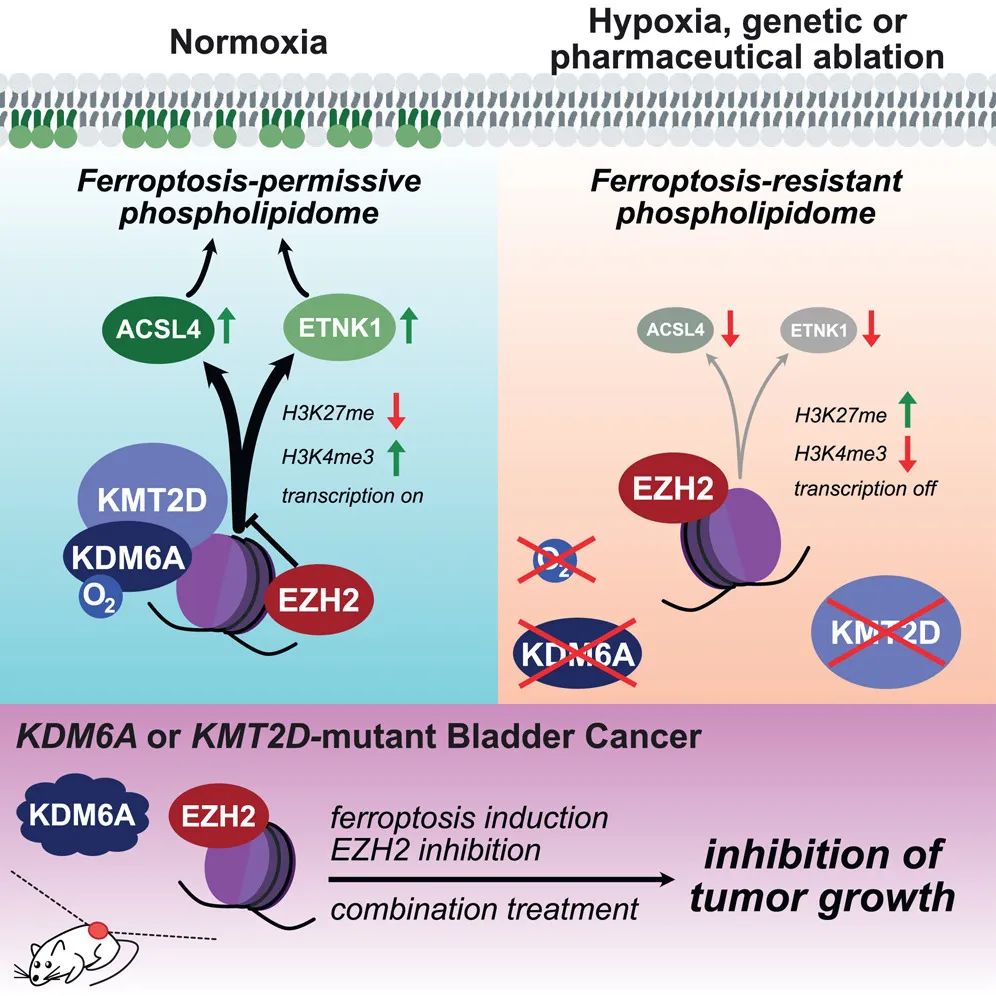
该研究首次发现,缺氧通过抑制组蛋白去甲基化酶KDM6A活性,以缺氧诱导因子(HIF)非依赖的方式抑制铁死亡。该研究明确了 KDM6A 作为非经典氧感应器在铁死亡过程中的功能,揭示了缺氧对铁死亡的调控路径不依赖于传统的 PHD-HIF 通路,在机制上具有突破性意义。
在这项最新研究中,研究团队发现,适应低氧环境的细胞对铁死亡具有显著的抗性,而且这种抗性与脯氨酰羟化酶(PHD)和缺氧诱导因子(HIF)转录因子介导的经典氧感知通路无关。
相反,缺氧通过抑制KDM6A(一种肿瘤抑制因子和氧依赖性组蛋白去甲基化酶)来抑制铁死亡,导致其转录靶点(包括脂质代谢酶 ACSL4 和 ETNK1)的表达降低,从而将细胞磷脂谱重塑为铁死亡抵抗状态。
与癌症相关的是,对致癌组蛋白甲基转移酶 EZH2 进行药理学抑制(EZH2 与 KDM6A 的活性相对立),恢复了携带 KDM6A 突变的膀胱肿瘤异种移植组织对铁死亡的敏感性。
该研究的核心发现:
长期缺氧可通过缺氧诱导因子(HIF)非依赖的方式抑制铁死亡;
缺氧通过抑制 KDM6A 重塑磷脂组以抵御铁死亡;
KDM6A 肿瘤抑制因子缺失在中常见,会导致铁死亡抵抗;
EZH2 抑制可恢复 KDM6A 突变膀胱癌的铁死亡敏感性。