Cell:顾名夏/苗一非/郭敏哲团队,在同一个球状体中实现肺和肠道类器官的血管化,成功构建多谱系类器官
时间:2025-08-05
该研究还在tvHLuO中识别出了一种最近发现的人类呼吸性细支气管分泌细胞(RAS)类型,这种细胞类型表达SCGB3A2和SCGB1A1。这种独特的细胞类型位于呼吸性细支气管中,这一区域在小鼠中是缺失的。
对分泌液进行蛋白质组学分析确认,除了所有主要的肺分泌产物(包括表面活性蛋白和黏蛋白)外,还观察到了SCGB3A2、SCGB1A1和SFTPB肽的分泌。
为了揭示促进肺上皮发育和成熟的细胞间相互作用,在tvHLuO中绘制了空间信息,并将其与公开的人类胎儿肺图谱以及空间图谱进行了进一步比较。关键的L-R对(WNT5A-ANTXR1和FGF18-FGFR1),由周围的间充质或上皮细胞表达,并与tvHLuO中的上皮成熟相关(图5E-H)。

图5
6、生物工程支架上的肺泡结构形成
为了在体外重建具有相邻上皮、毛细血管内皮、间充质和细胞外基质的肺泡结构,将分离的vHLPO重新种植到气液界面(ALI)培养中,以诱导远端肺结构的形成。
分离的vHLPO细胞自主形成了类似肺泡囊的结构,而主要由iPSC衍生的II型肺泡上皮细胞(iAT2)组成的cLPO仅形成了单层结构。
进一步优化了之前报道的三维多孔明胶甲基丙烯酰(GelMA)肺支架,通过加入透明质酸甲基丙烯酰(HAMA)来促进上皮、间充质和血管EC的排列。
将分离的vHLPO种植到肺支架上后,EC沿着水凝胶囊表面排列并围绕肺上皮芽。当在支架上生长时,肺泡细胞类型以适当的肺泡几何结构出现,例如类似AT1和AT2的肺上皮以及类似aCap和gCap的肺内皮。
此外,生长在支架上的肺类器官细胞的超微结构显示出类似于胎儿肺中观察到的AT1和AT2细胞的形态:含有糖原但没有板层小体的立方细胞(双能祖细胞BPs)、含有糖原和板层小体的立方细胞(早期AT2细胞)以及部分扁平的细胞(早期AT1细胞)。
与整体成像结果一致,观察到早期AT1细胞与内皮细胞之间的物理邻接,这表明早期功能性屏障单元的形成已经开始(图6)。
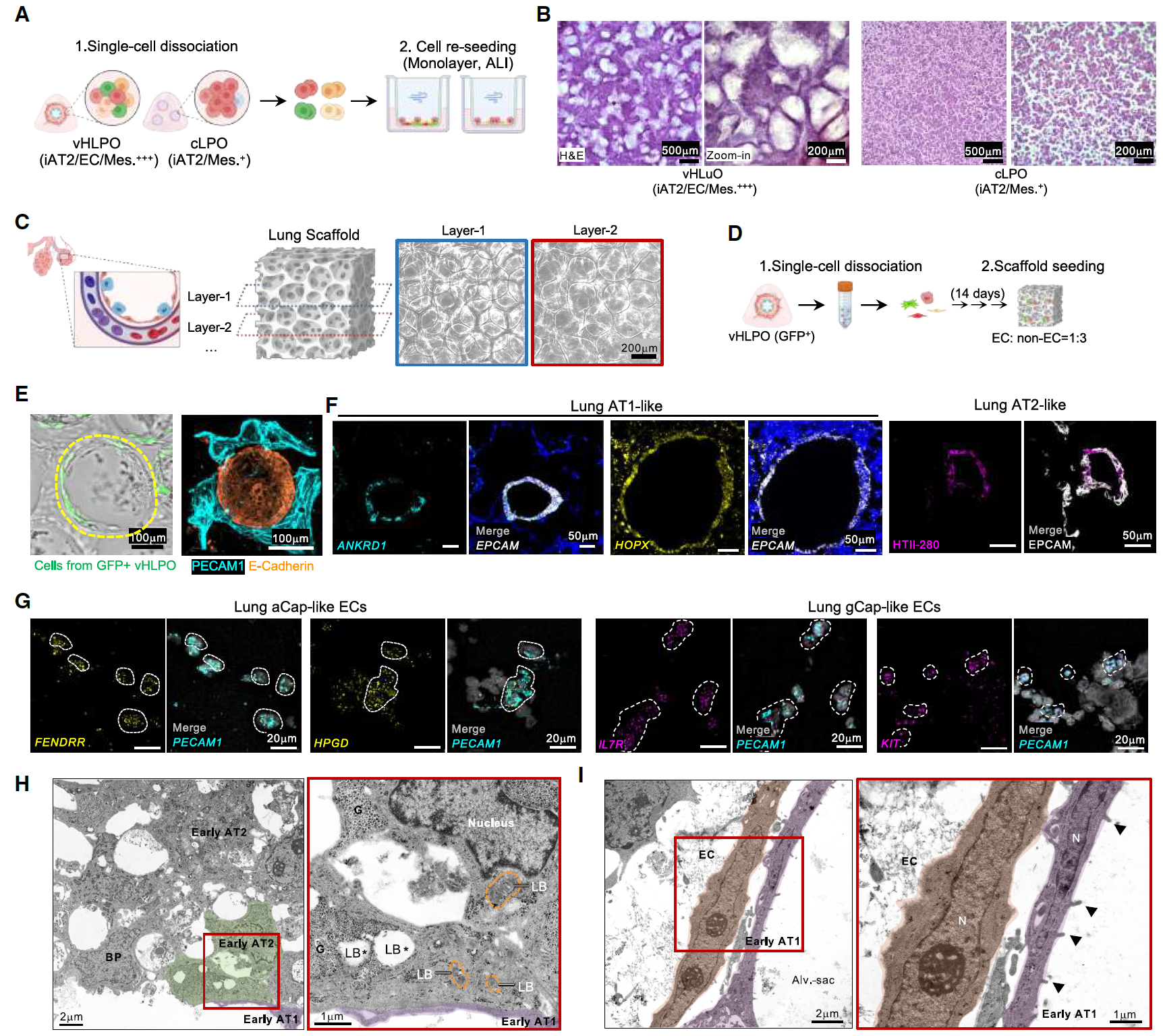
图6
7、基于FOXF1突变的先天性肺缺陷模型构建
传统肺类器官缺乏血管和间充质成分,限制了其在研究肺血管疾病中的应用。ACDMPV(肺泡毛细血管发育不良伴肺静脉错位)或ACD(肺动脉高压相关肺发育不良)是一种由FOXF1基因突变或缺失引起的致命先天性肺部疾病,目前尚无有效治疗方法。
从三名ACD患者的iPSC和三名健康对照组的iPSC中生成了vHLuO。其中一名患者(ACD-1,也称为 FOXF1.1 iPSC系)存在包含FOXF1基因位点的1.7Mb染色体缺失,另外两名患者则携带不同的FOXF1基因杂合突变(c.166C G和c.253T A,分别为ACD-2和ACD-3)。
ACD患者的vHLuO观察到毛细血管形成显著减少,aCap和gCap群体也有所减少。尽管肺上皮细胞中没有FOXF1表达,但观察到远端肺上皮细胞(SOX9⁺, NKX2-1⁺)数量减少,AT1细胞分化受损(HOPX⁺),以及损伤相关的AT1/AT2中间细胞(CLDN4⁺/NKX2.1⁺)积累。
值得注意的是,这些细胞表型与人类ACD肺组织中发现的非常相似(图7),并且由于缺乏FOXF1⁺间充质细胞和内皮细胞成分,这些表型无法在Foxf1突变小鼠模型或传统肺类器官中完全复制。
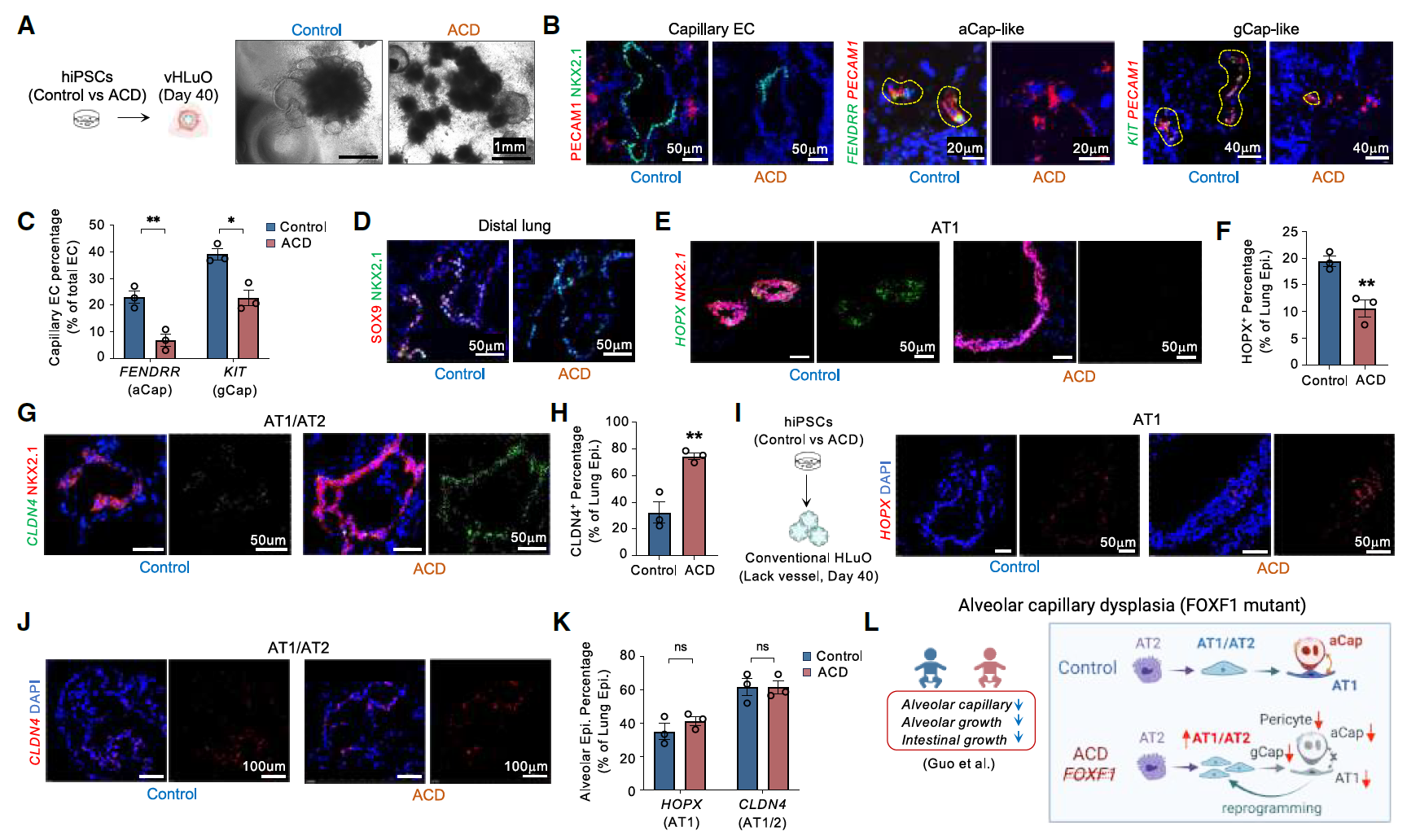
图7
