无需体外培养!体内 CAR-T:癌症治疗的“即插即用”革命
时间:2025-09-17
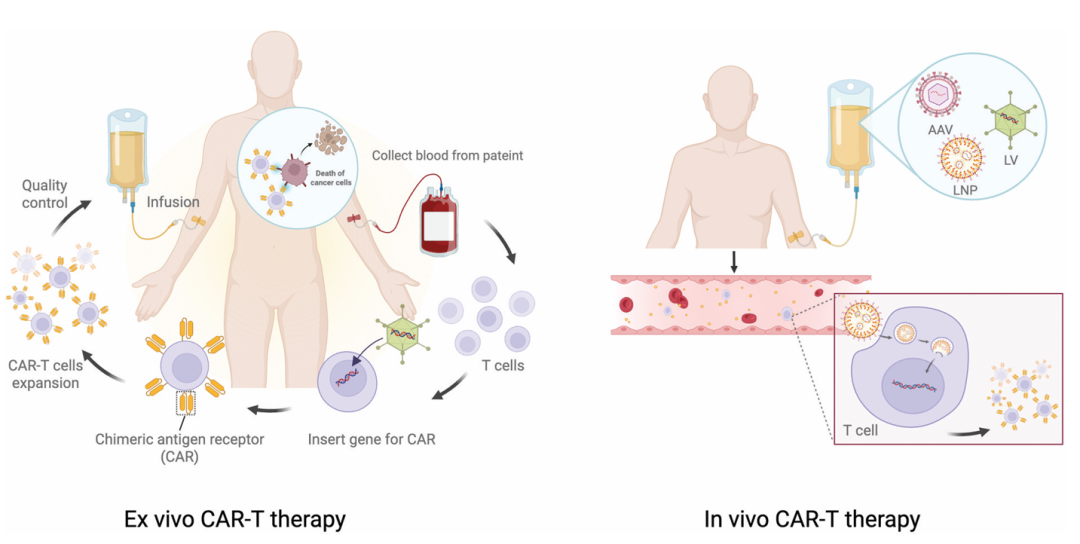
图 2:体外与体内 CAR-T 疗法流程对比
左:体外 CAR-T 需经历 采血 - 改造 - 扩增 - 回输 多步骤;右:体内 CAR-T 通过静脉注射载体,直接在体内完成 T 细胞改造,无需体外操作。
三、体内 CAR-T 疗法:无需体外培养的 即插即用 革命
为突破体外疗法的局限,体内 CAR-T 疗法应运而生:通过靶向基因递送系统,将 CAR 基因直接导入患者体内的 T 细胞,使其在体内 就地改造 为 CAR-T 细胞(图 2 右)。这一策略的核心优势包括:
省去体外培养步骤:无需分离和扩增 T 细胞,大幅缩短治疗周期(从数周缩减至数天),降低成本。
减少 T 细胞耗竭:体外操作可能导致 T 细胞功能受损,而体内改造的 T 细胞更贴近生理状态,持久性更强。
精准调控功能:通过载体设计实现 T 细胞特异性靶向,减少对正常细胞的影响,降低毒性。
例如,在急性淋巴细胞白血病小鼠模型中,通过静脉注射携带 CAR 基因的腺相关病毒(AAV),成功在体内生成 CAR-T 细胞,高效清除白血病细胞且无明显全身毒性,为临床转化奠定了基础。
四、基因递送系统:体内 CAR-T 的 运输车
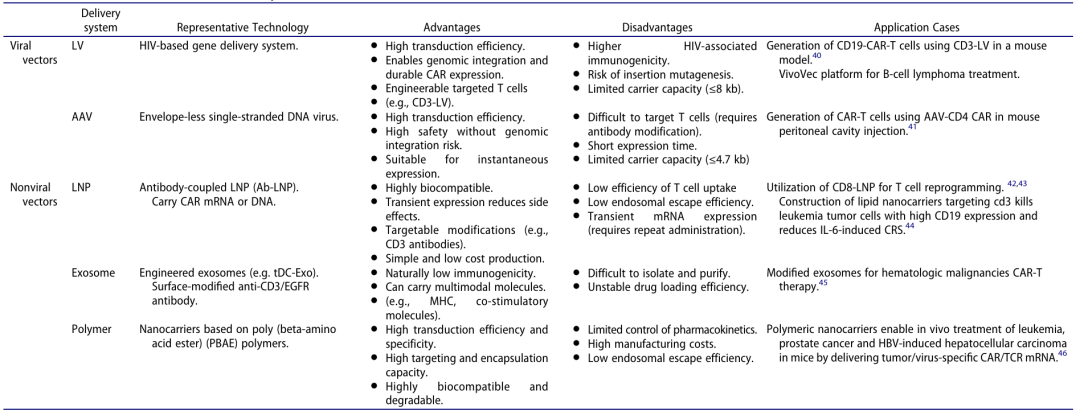
体内 CAR-T 的核心是安全高效的基因递送系统,需满足 T 细胞靶向性、低毒性、高转导效率等要求。目前主要分为病毒载体和非病毒载体两大类(图 3,表 1)。
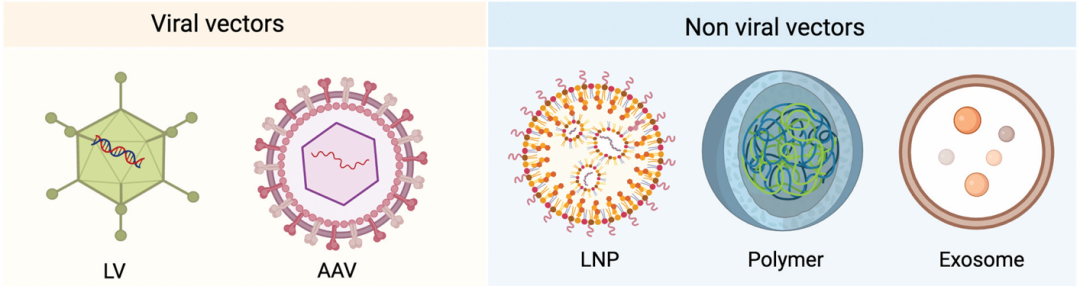
图 3:体内 CAR-T 递送载体分类
病毒载体以慢病毒和 AAV 为主,非病毒载体包括脂质纳米颗粒(LNP)、聚合物纳米载体和外泌体。
表 1:体内 CAR-T 递送载体的分类与特点
(一)病毒载体:高效但需平衡安全
慢病毒载体:通过改造包膜蛋白(如替换为抗 CD3 scFv)实现 T 细胞靶向,无需激活 T 细胞即可高效转导。例如,Umoja 公司的VivoVec 平台采用 cocal 假型慢病毒,表面展示抗 CD3 scFv,在人源化小鼠中成功生成抗 CD19 CAR-T 细胞,有效清除 B 细胞且安全性良好。
AAV 载体:无整合风险,免疫原性低,适合短期表达。通过衣壳改造(如 AAV-DJ)可增强 T 细胞转导效率,在小鼠模型中实现 CAR-T 细胞体内生成,抑制 T 细胞白血病生长。
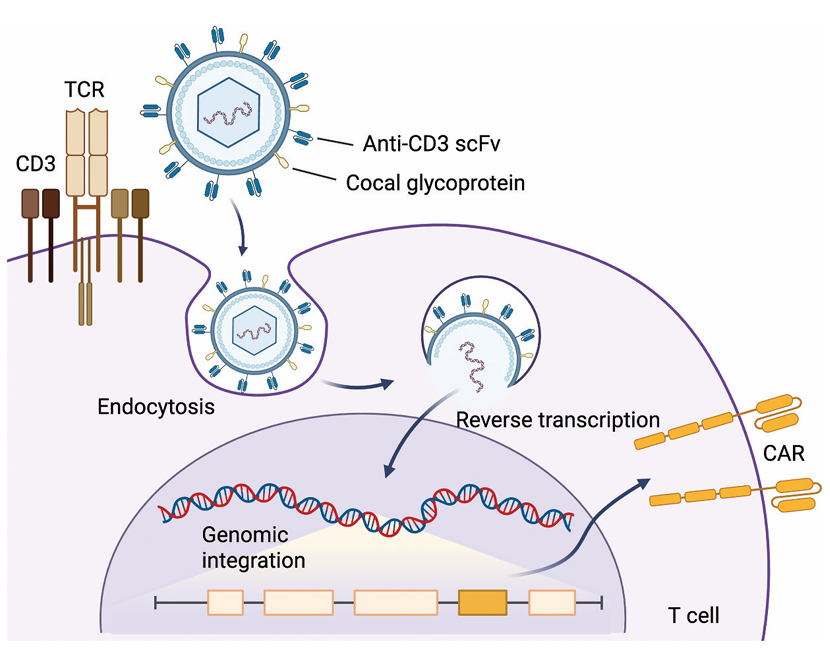
图 4:体内 CAR-T 细胞的病毒递送系统
(二)非病毒载体:安全且易于规模化生产
脂质纳米颗粒(LNP):通过表面修饰抗 CD3 抗体靶向 T 细胞,包裹 CAR mRNA 实现瞬时表达,减少 CRS 风险。例如,靶向 CD3 的 LNP 同时携带 CD19-CAR 和 IL-6 shRNA,在小鼠中生成 CAR-T 细胞并降低 IL-6 相关毒性。
聚合物纳米载体:如 PBAE 载体可高效包裹 CAR mRNA,系统给药后延长小鼠生存期,尤其在实体瘤中因穿透能力强而具优势。
外泌体:天然来源的纳米囊泡,经工程化改造后表面表达抗 CD3/CD28 scFv,靶向 T 细胞并递送 CAR mRNA,在体内诱导抗瘤活性。
五、临床突破:体内 CAR-T 从实验室走向患者
近年来,体内 CAR-T 疗法的临床转化取得显著进展,在血液肿瘤和实体瘤中均展现出潜力:
(一)血液肿瘤:疗效与安全性双优
UB-VV100(Umoja):在非人灵长类动物中,静脉注射编码抗 CD20 CAR 的 VivoVec 颗粒,实现 B 细胞长期耗竭,无严重毒性。
ESO-T01:针对复发/难治性多发性骨髓瘤的Ⅰ期试验中,4 例患者中 2 例达到严格完全缓解,2 例部分缓解,CAR-T 细胞在多组织中检出,证实体内生成与扩增能力。
CD19 靶向疗法:1 例复发 B 细胞急性淋巴细胞白血病患者接受体内 CAR-T 治疗后,1 个月内实现微小残留病阴性完全缓解,无严重不良反应。
(二)实体瘤:突破微环境壁垒
实体瘤因免疫抑制微环境(如 Tregs、MDSCs 浸润)和纤维化屏障,对 CAR-T 疗法抗性强。体内 CAR-T 通过局部递送策略取得突破:
淋巴节点样支架:将 CAR-T 细胞与支架结合植入肿瘤附近,促进其扩增并增强肿瘤浸润,在小鼠模型中显著抑制实体瘤生长。
MASTER 平台:可植入的藻酸盐支架负载 T 细胞和 CAR 基因载体,1 天内完成体内 CAR-T 生成,有效控制淋巴瘤生长。
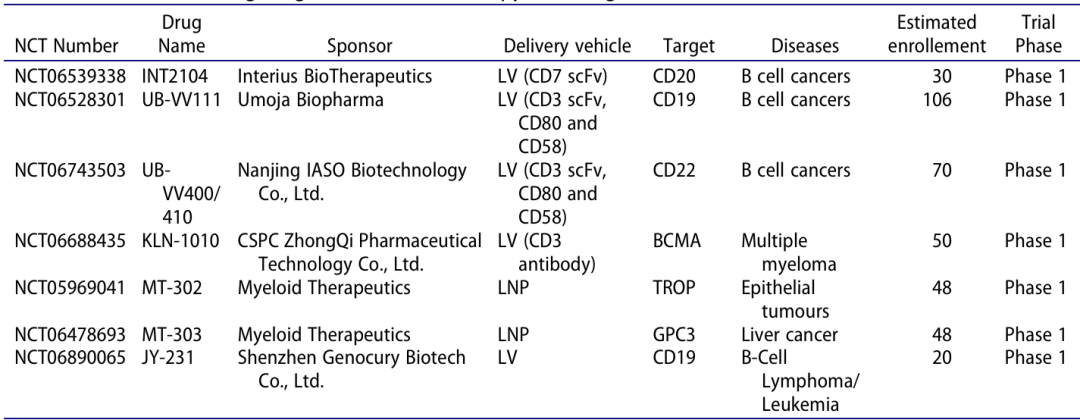
表 2:针对恶性肿瘤的体内 CAR-T 疗法临床试验
六、挑战与应对:体内 CAR-T 的 拦路虎 如何解决?
尽管前景广阔,体内 CAR-T 仍面临多重挑战,研究者已提出针对性解决方案:
(一)基因递送的安全性
插入突变风险:慢病毒整合可能导致致癌基因激活,通过优化启动子和增强子可降低风险。
免疫反应:病毒载体的衣壳蛋白可能引发抗体反应,非病毒载体(如 LNP)可减少免疫原性,但需提升转导效率。
(二)T 细胞耗竭与持久性
优化 CAR 结构:引入 4-1BB 共刺激域增强 T 细胞存活;第五代 CAR 通过细胞因子受体域提升活化效率。
联合疗法:与免疫检查点抑制剂(如 PD-1 抗体)联用,阻断抑制信号;通过 CRISPR/Cas9 敲除耗竭相关基因(如 PD-1)。
(三)实体瘤微环境的阻碍
重塑微环境:使用血管破坏剂(如 CA4P)改善肿瘤血流,增强 CAR-T 浸润;靶向 TGF- 、IL-10 等抑制性细胞因子。
多靶点设计:双特异性 CAR 同时识别多个肿瘤抗原,减少抗原逃逸;第四代 CAR 分泌 IL-12 等细胞因子,逆转免疫抑制。
七、未来展望:从 个体化 到 大众化 的跨越
体内 CAR-T 疗法正朝着更高效、安全、普惠的方向发展:
技术融合:结合多组学分析筛选肿瘤特异性抗原,利用AI 设计优化载体(如预测 LNP 最佳结构),加速疗法迭代。
通用型 CAR-T:通过基因编辑敲除 T 细胞表面 MHC 分子,开发 现成 CAR-T 产品,降低成本并缩短治疗时间。
适应症拓展:除癌症外,体内 CAR-T 已在心脏纤维化等疾病中显效,未来可能应用于自身免疫病等领域。
