Immunity:中山大学邝栋明/陈东萍团队揭示肝癌通过多胺代谢重编程,削弱免疫治疗效果
时间:2025-06-05
来源:生物世界 2025-06-05 09:27
在这项最新研究中,研究团队研究了肝细胞癌(HCC)的代谢特征,这是一种对免疫检查点阻断(ICB)疗法反应不佳的癌症,是肝癌的主要类型。中山大学邝栋明教授、陈东萍副教授团队在 Cell 子刊Immunity上发表了题为:Efflux of N1-acetylspermidine from hepatoma fosters macrophage-mediated immune suppression to dampen immunotherapeutic efficacy的研究论文。
该研究基于多队列样本,整合代谢组学、转录组学测序和单细胞测序等多组学数据,并结合体内外功能实验,系统阐明了通过代谢重编程产生并主动外排N1-乙酰亚精胺(N1-acetylspermidine,N1-Ac-Spd),诱导抑制性的巨噬细胞和调节性 T 细胞,进而削弱治疗效果。该研究为靶向多胺代谢轴以增强肿瘤免疫治疗提供了理论基础和潜在的干预靶点。

在这项最新研究中,研究团队研究了肝(HCC)的代谢特征,这是一种对免疫检查点阻断(ICB)疗法反应不佳的癌症,是肝癌的主要类型。
多胺代谢在肝细胞癌样本中增强。在分析的多胺谱中,与非肿瘤性肝组织相比,N1-乙酰亚精胺(N1-acetylspermidine,N1-Ac-Spd)在肝细胞癌组织中积累,并且在配对血浆中升高。直接注射N1-Ac-Spd,在临床前动物模型中促进了肿瘤的进展,并削弱了免疫检查点阻断(ICB)疗法的治疗效果。
炎症巨噬细胞使肝中精胺/亚精胺N1-乙酰转移酶 1(SAT1)的表达增加,从而通过多胺转运蛋白 SLC3A2 增加 N1-Ac-Spd 的外排。
从机制上来说,外排的 N1-Ac-Spd 反作用于巨噬细胞,以电荷依赖的方式激活了 SRC 信号传导,进而诱导了 CCL1+ 巨噬细胞极化、CCR8+调节性 T 细胞的募集,从而形成免疫抑制性的肿瘤微环境。
直接阻断 N1-Ac-Spd 的合成,以及通过靶向 SLC3A2、SAT1 或 CCL1 来阻断 N1-Ac-Spd 介导的免疫抑制通路,均可显著增强 免疫检查点阻断(ICB)疗法的抗肿瘤效果。
该研究的核心发现:
肝细胞癌中N1-乙酰亚精胺(N1-Ac-Spd)外排增强,降低免疫检查点阻断疗法的效果;
炎症巨噬细胞促使肝细胞癌 SAT1 释放 N1-Ac-Spd;
N1-Ac-Spd 以电荷依赖的方式使 CCL1+巨噬细胞极化;
CCL1+巨噬细胞招募调节性 T 细胞以降低免疫检查点阻断疗法的疗效。
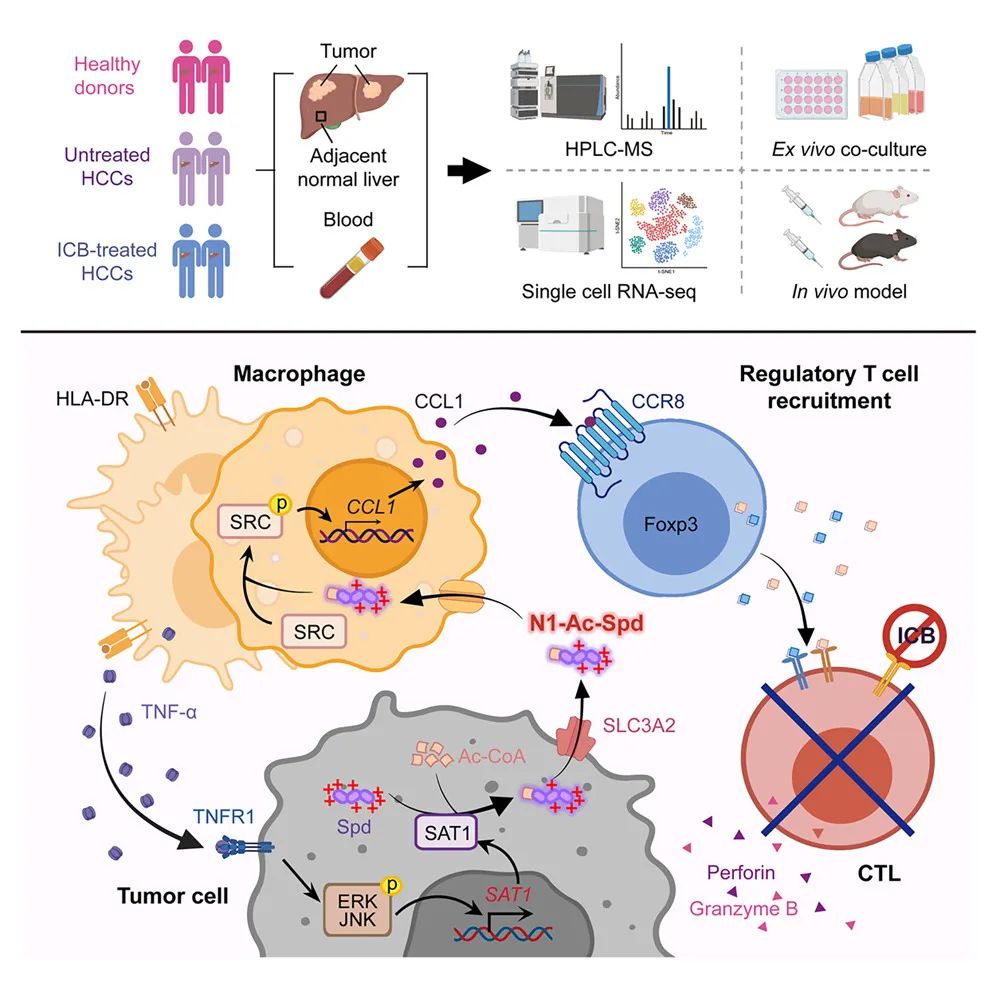
这些研究结果揭示了代谢重编程促进免疫抑制性肿瘤微环境形成的机制,这对肝细胞癌的治疗具有重要意义。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
