天津大学最新Cell子刊:开发新型铜死亡癌症疗法
时间:2025-07-17
来源:生物世界 2025-07-17 09:28
该研究开发了基于点击化学的共价有机框架,引发细胞内铜积累级联反应,抑制肿瘤细胞生长,实现放大的用于铜死亡癌症治疗。铜是从细菌和真菌到植物、动物以及人类生命活动的基本元素,作为必需酶的辅助因子,在生命活动中发挥着必不可少的作用。铜在人体中是一种微量元素,细胞内铜离子的浓度通过主动稳态机制保持在非常低的水平,一旦超过阈值,铜就会变得有毒,导致细胞死亡。
铜死亡(Cuproptosis)是于 2022 年发现的一种新型程序性细胞死亡方式,其发生机制与细胞内铜离子稳态失衡及蛋白质脂酰化过程的异常调控密切相关。具体而言,铜离子过载可导致线粒体三羧酸循环的关键酶(例如 DLAT)的脂酰化修饰紊乱,引发线粒体和蛋白质毒性应激,最终触发独特的细胞死亡通路。
铜死亡疗法具有癌症治疗的巨大潜力,但这需要克服对铜积累的抵抗机制,同时避免全身毒性。
2025 年 7 月 11 日,天津大学张育淼教授团队在 Cell 子刊Cell Biomaterials上发表了题为:Covalent organic framework eliciting a click-based intracellular copper accumulation cascade for cuproptosis cancer therapy的研究论文。
该研究开发了基于点击化学的共价有机框架,引发细胞内铜积累级联反应,抑制生长,实现放大的用于铜死亡癌症治疗。

在这项新研究中,研究团队开发了一种铜死亡疗法纳米系统 P1+P2@COF@F127-D,仅利用内源性铜通过级联富集实现基于铜死亡的癌症治疗。该纳米系统通过向癌细胞引入铜输出抑制剂DC_AC50来启动级联反应,该抑制剂会特异性地使癌细胞内亚铜离子(Cu+)水平持续升高,通过阻断铜的主要储存和运输途径,导致不可逆的铜死亡。
具体来说,将谷氨酰胺酶-1(GLS1)的小分子抑制剂C147的两种前药 P1 和 P2 封装在谷胱甘肽响应型含二硫键的共价有机框架(ss-COF)中,得到 P1+P2@COF。DC_AC50 通过谷胱甘肽响应型连接子与泊洛沙姆127(F127)共价连接,得到的偶联物 F127-DC_AC50(F127-D)随后用于修饰 P1+P2@COF,得到水分散性P1+P2@COF@F127-D纳米颗粒。
当这些纳米颗粒被癌细胞摄取后,DC_AC50 和前药得以释放,DC_AC50 抑制癌细胞中过表达的ATOX1和 CCS 蛋白与亚铜离子(Cu+)的相互作用,导致游离的 Cu+ 积累,从而通过破坏三羧酸循环以诱导癌细胞铜死亡。另一方面,游离的 Cu+ 的存在触发了 P1 和 P2 的 CuAAC 偶联反应,促进了 GLS1 抑制剂 C147 的原位合成,随后显著抑制了细胞内谷胱甘肽(GSH)的水平以及 GSH-Cu 复合物的形成。结果,GSH-Cu 复合物的减少进一步促进了 C147 的生成,形成了一个以 Cu+ 增加 - GLS1 抑制剂生成增加 - GSH 减少 - Cu+增加 为特征的自我强化反馈回路,通过基于内源性铜的机制增强了抗癌效果。
在小鼠瘤模型中,P1+P2@COF@F127-D 表现出很高的抗肿瘤功效,且未显示出明显的全身毒性。
该研究的亮点:
细胞内源性亚铜离子(Cu+)被利用来触发细胞内铜死亡;
在癌细胞中特异性触发点击化学以增强铜死亡;
设计了一种铜-谷胱甘肽级联反应,放大细胞内的铜死亡效应。
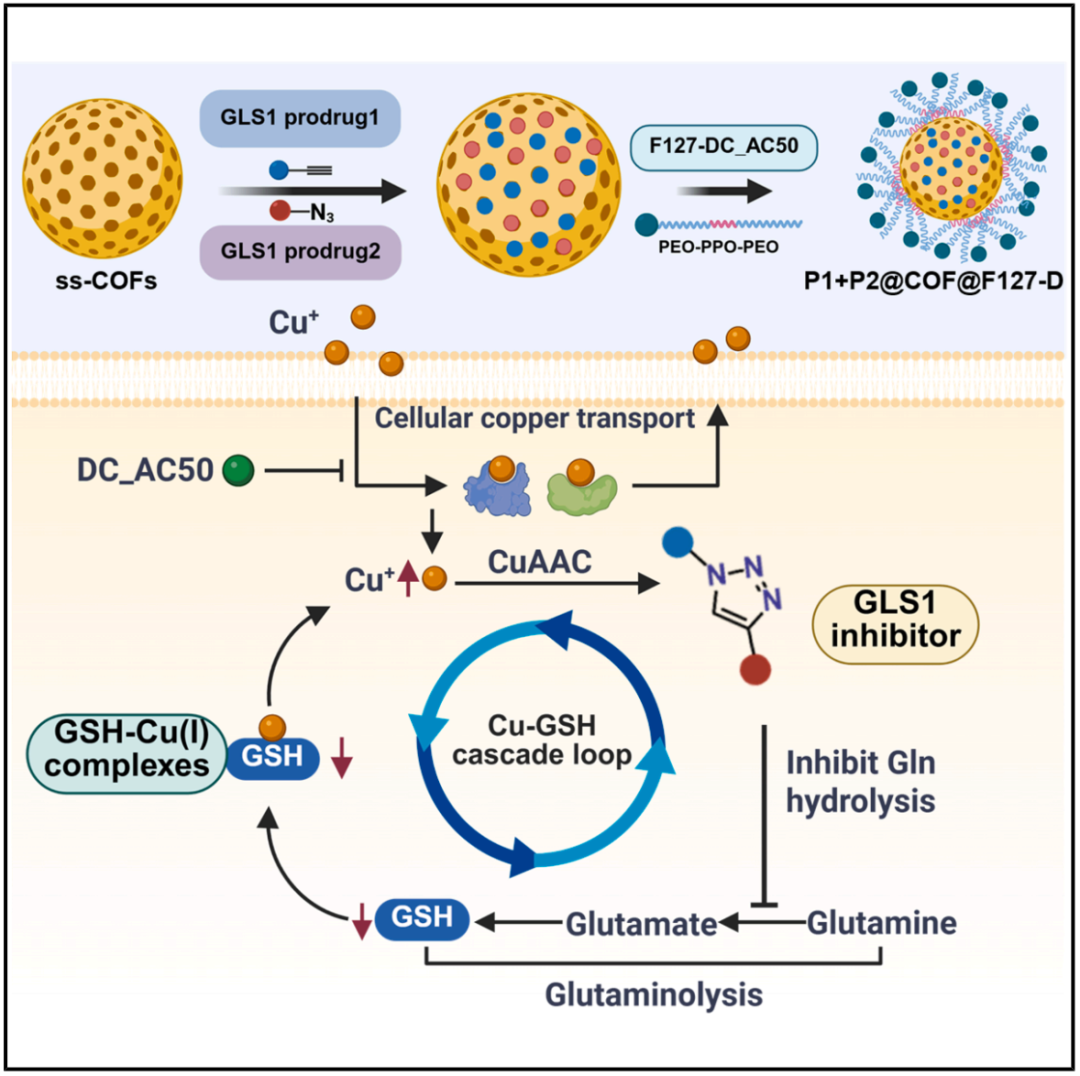
总的来说,该研究成功开发了一种基于共价有机框架(COF)的铜死亡疗法纳米系统,无需外源铜,利用内源性铜引发铜-谷胱甘肽介导的细胞内级联反应,触发细胞内铜积累,抑制肿瘤细胞生长,从而实现放大的铜死亡癌症治疗。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
