Cell子刊:姜学军团队揭示铁死亡新路线
时间:2025-09-02
来源:生物世界 2025-09-02 10:34
该研究发现,溶酶体抑制剂能够抑制半胱氨酸剥夺诱导的(CDI)铁死亡,即使在自噬缺陷细胞中也是如此,这表明溶酶体抑制剂的作用不止于自噬。铁死亡(ferroptosis)是一种由铁依赖性磷脂过氧化以及随后的膜破裂所导致的新型细胞死亡形式。
然而,自 2012 年首次提出铁死亡以来,铁是如何在细胞内积累并推动铁死亡的,这一关键过程仍未完全搞清楚。
2025 年 8 月 25 日,纪念斯隆-凯特琳癌症中心姜学军教授团队(刘雪松博士和赵泽川博士为共同第一作者)在Molecular Cell期刊发表了题为:Endocytosis is essential for cysteine-deprivation-induced ferroptosis的研究论文。
该研究揭示了细胞内吞介导的铁累积在半胱氨酸缺乏诱导的铁死亡中的重要作用。这一发现不仅颠覆了我们对溶酶体抑制剂作用机制的认识,也提示铁死亡可能存在不同的执行路线。

铁储存蛋白 ferritin(铁蛋白)的自噬降解,通过增加细胞质中具有生物活性的铁含量来促进铁死亡,这或许解释了为何溶酶体抑制剂能够抑制铁死亡。
令人惊讶的是,该研究发现,溶酶体抑制剂能够抑制半胱氨酸剥夺诱导的(CDI)铁死亡,即使在自噬缺陷细胞中也是如此,这表明溶酶体抑制剂的作用不止于自噬。
随后,研究团队发现,转铁蛋白(transferrin)的网格蛋白介导的内吞作用(CME)对于CDI铁死亡至关重要。抑制溶酶体蛋白水解活性未能阻止铁死亡,而破坏内体酸化以及消除内吞蛋白 AP2M1 均可阻止铁死亡。相反,用柠檬酸铁铵来补充细胞铁(不依赖内吞作用)而非通过转铁蛋白,可恢复内吞作用缺陷的细胞中的 CDI 铁死亡。
出乎意料的是,消除内体酸化、网格蛋白介导的内吞作用(CME)以及由此导致的细胞活性铁含量增加,并不能阻止因直接抑制抵抗铁死亡的 GPX4 而引发的铁死亡。
该研究的核心发现:
溶酶体抑制剂能够独立于自噬抑制半胱氨酸剥夺诱导的(CDI)诱导的铁死亡;
内吞作用是 CDI 铁死亡所必需的,但不是由 GPX4 耗竭诱导的铁死亡所必需的;
内吞缺陷会降低细胞内的铁含量并阻止 CDI 铁死亡;
转铁蛋白通过内吞作用的内化驱动 CDI 铁死亡。
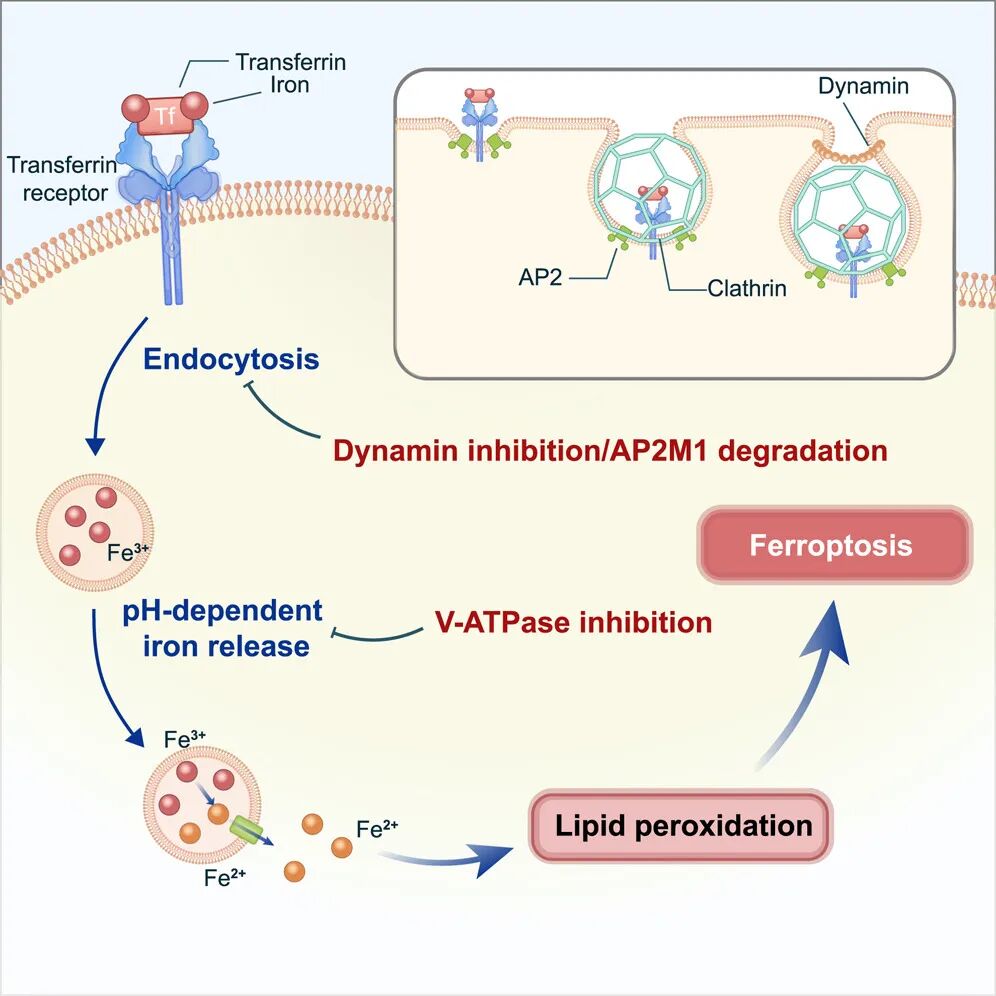
综合来看,这项研究揭示了内吞作用对于半胱氨酸剥夺诱导的(CDI)铁死亡具有至关重要的作用,这不仅颠覆了我们对溶酶体抑制剂作用机制的认识,也提示铁死亡可能存在不同的执行路线。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
