相分离研究登上Nature:超越转录调控,mRNA协调易凝聚蛋白稳态
时间:2025-10-07
来源:生物世界 2025-10-07 10:16
该研究揭示了细胞核内的一个复杂而又精妙的内稳态调控机制——interstasis,该机制协调了细胞中的易通过相分离形成生物分子凝聚体的蛋白质的表达。含有内在无序区(intrinsically disordered region,IDR)的蛋白质的浓度必须受到严格控制,以维持细胞内稳态。然而,我们对于这些倾向于聚集在无膜凝聚体中的蛋白质的集体控制机制了解,还远不如对通过膜结合细胞器介导的通路那样透彻。
近日,弗朗西斯 克里克研究所、伦敦国王学院的研究人员在国际顶尖学术期刊Nature上发表了题为:Collective homeostasis of condensation-prone proteins via their mRNAs的研究论文。
该研究揭示了细胞核内的一个复杂而又精妙的内稳态调控机制 interstasis,该机制协调了细胞中的易通过相分离形成生物分子凝聚体的蛋白质的表达,当这类蛋白质浓度过高时,会触发其自身mRNA 被 捕获 并隔离在核斑(nuclear speckles)中,从而阻止其进一步翻译成更多蛋白质,最终降低该蛋白质浓度,而当该蛋白质浓度下降后,负反回路环关闭,该研究还进一步揭示了该回路的调控开关。这一负反馈回路为核斑的功能增添了新维度,强调了 RNA 序列特征与蛋白质结构域架构在细胞调控中的相互作用。

在多个真核生物物种中的适应性筛选表明,当剂量增加时,含有内在无序区(intrinsically disordered region,IDR)的蛋白质更有可能具有毒性。在酵母中,由单个含 IDR 蛋白质的剂量增加所诱导的毒性,已被认为与这些蛋白易于相分离并形成生物分子凝聚体的倾向有关。
易发生相分离的蛋白质在蛋白质与 RNA 的丰度之间存在最大的不匹配,这表明转录后机制对蛋白质丰度有着强烈的影响。许多蛋白质能够与自身基因的 RNA 或 DNA 相互作用,然而目前尚无已知的传感器或效应器能够调节易凝聚蛋白质的集体表达。
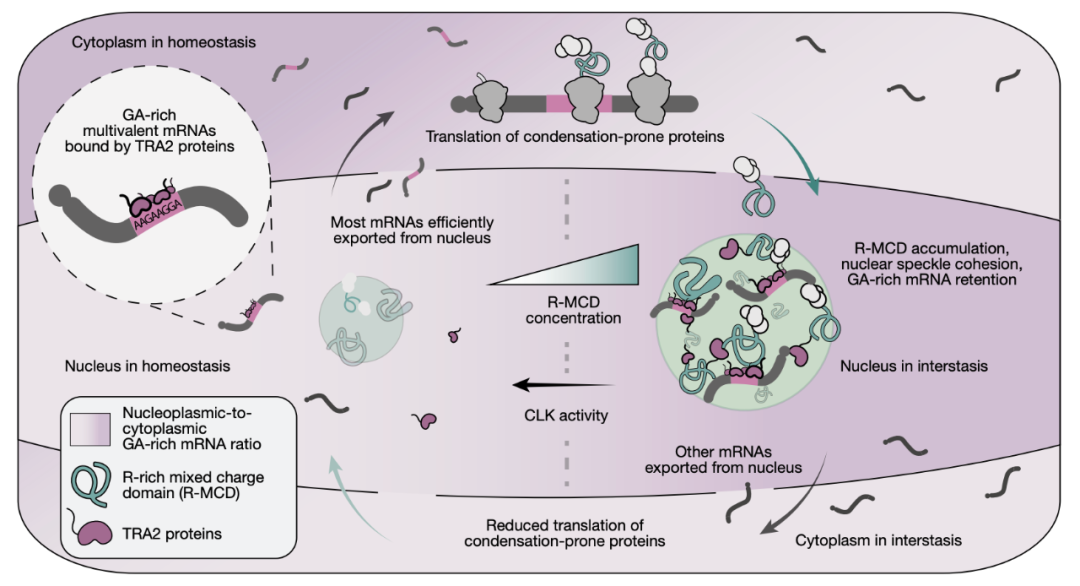
蛋白质的共凝聚在一定程度上取决于其内在无序区(IDR)中短基序的分子语法以及生物物理性质相似的氨基酸。许多 IDR 包含重复的氨基酸排列,因此被归类为低复杂度结构域(LCD)。 一类 LCD 是 R-MCD,其中精氨酸与其他带正电荷和负电荷的氨基酸交错分布。R-MCD能够促进蛋白质定位到核斑(nuclear speckles)中。
研究表明,人工 R-MCD 的显著过表达会增强核斑的内聚性,从而导致所有多聚腺苷酸化 mRNA(polyadenylated mRNA)被滞留在核斑内。这一现象突显了对这类蛋白质进行稳态协同调控的重要性。
该研究发现了一种复杂而又精妙的细胞内稳态调控机制 interstasis,这是一种集体性的负反馈细胞内稳态机制,当细胞内由 RNA 和蛋白质形成的无膜凝聚体(例如核斑)中的特定蛋白质浓度过高时,会触发其自身 mRNA 被 捕获 并隔离在该凝聚体中,从而阻止其被翻译成更多蛋白质,最终降低该蛋白质的浓度。
核斑(Nuclear Speckles)是一种典型的生物分子凝聚体,当富含精氨酸的混合电荷结构域(R-MCD)的蛋白质过多时,它们会使核斑的内聚性(cohesion)过强,变得 过粘 。这种物理状态的改变充当了 传感器 ,检测到蛋白质浓度过高的信号。这种 过粘 的核斑会开始选择性捕获那些编码凝聚倾向蛋白的 mRNA。
这种选择性基于遗传密码的结构和保守的密码子使用偏好,例如,编码 R-MCD 的 mRNA 通常自身也富含嘌呤(AG-rich)的重复序列,形成多价区域。这种相似的 RNA 结构使得它们能被同样聚集在核斑中的特异性 RNA 结合蛋白(例如 TRA2 蛋白)识别和结合。被捕获的 mRNA 被滞留在核斑内部,无法进入细胞质被核糖体翻译,从而导致相应的蛋白质合成减少、浓度下降。当蛋白质浓度下降后,核斑的内聚性恢复正常,负反馈回路关闭。
研究团队进一步揭示了interstasis 的调控开关 CLK 激酶通过对TRA2蛋白进行磷酸化修饰,可以阻止其定位到核斑中。这意味着磷酸化作用会抑制 interstasis,使反馈循环无法启动。这为细胞提供了一个精细调控这个机制的 开关 。
这些发现解决了一个关键问题 解释了细胞如何集体协调(collective control)一系列具有高度剂量敏感性的、易凝聚蛋白质的表达,防止它们因过表达而引发相分离失控、形成有毒聚集体,从而导致细胞功能紊乱或疾病(例如神经退行性疾病)。这些发现也揭示了全新的调控维度 将蛋白质的生化特性(相分离能力)、mRNA 的序列特征(密码子偏好)和亚细胞结构的物理状态(凝聚体粘度)巧妙地联系了起来,形成了一种超越传统转录调控的快速响应机制。
总的来说,Interstasis是一个极其聪明的细胞内稳态调控机制 细胞利用凝聚体本身作为传感器,通过其物理状态的变化,直接招募并沉默那些一旦过多就会 捣乱 的蛋白质的 mRNA,从而实现集体的自我稳态维持。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
