哈医大最新研究登上Cell头条:从多组学视角揭示不同器官系统的衰老差异
时间:2025-10-18
来源:生物世界 2025-10-18 16:38
这项研究推进了我们对衰老异质性的理解,为延缓器官特异性衰老以及预防或治疗相关慢性疾病的精准医疗策略提供了信息。有助于推动旨在延长健康寿命的创新治疗策略的开发。 近日,哈尔滨医科大学附属第一医院、扬州大学附属医院、佳木斯大学附属第一医院等单位合作的一篇研究论文登上了登上了Cell Press官网头条。
该论文以:Multi-omic underpinnings of heterogeneous aging across multiple organ systems(多组学视角下多器官系统异质性的基础)为题,于 2025 年 10 月 2 日发表在 Cell 子刊Cell Genomics上,哈尔滨医科大学附属第一医院涂应锋主任医师、扬州大学附属医院Li Zhaoyue博士为共同通讯作者,哈尔滨医科大学附属第一医院熊杰医生为论文第一作者。

衰老(Aging)是一种复杂的生物学过程,其特征是身体各系统和器官逐渐退化,是大多数常见慢性疾病和死亡的主要决定因素。从历史上看,医疗干预主要集中在预防、和治疗特定的年龄相关疾病上。然而,衰老生物学的进步表明,这些疾病是器官和系统特异性加速衰老的典型表现。
因此,通过普遍的全机体和个性化的器官特异性抗衰老治疗策略,将衰老本身作为多种疾病的共同根源加以干预,可能会带来远远超过针对特定疾病治疗的健康和经济效益。然而,将这一概念付诸实践仍面临重大挑战,原因在于对衰老的分子机制及其潜在治疗靶点的认识有限。
基于DNA 甲基化(DNA methylation)的表观遗传时钟是最早且研究最为广泛的衰老生物标志物之一。作为单组织或全组织衰老的生物标志物,它们可用于预测实际年龄和/或与年龄相关的终点。器官特异性衰老时钟的发展揭示了人体各器官系统衰老轨迹存在显著差异,一个器官的生物学衰老可能通过潜在的相互作用网络选择性地影响其他器官的衰老过程。然而,个体内部器官和组织衰老速度差异的分子机制仍不清楚。
鉴于延缓生物学衰老具有巨大的临床潜力,阐明介导表观遗传衰老和器官特异性衰老的相互作用网络,以及确定能够调控这些异质性衰老过程的分子靶点,将极大地促进年龄相关疾病策略从 分而治之 向 合而防之 的范式转变。
在这项新研究中,研究团队整合了基因组、表观基因组、转录组、蛋白质组和代谢组数据,并采用post-方法,系统地探究了由 9 种器官特异性衰老时钟量化得出的生物学年龄差(机器学习预测的生物学年龄与实际年龄之间的差异)以及由 4 种基于血液的表观遗传时钟评估得出的表观遗传年龄加速(表观遗传年龄与实际年龄之间的差异)的跨层分子基础。
该研究的目标是:1)阐明器官特异性衰老与基于血液的表观遗传衰老之间的遗传关联,揭示与多个器官系统异质性衰老相关的表型簇;2)确定与这些异质性衰老过程相关的候选基因药物靶点,并评估老药新用的机会;3)揭示由器官特异性衰老和基于血液的表观遗传衰老驱动的下游蛋白质组学和代谢组学效应,识别其可检测的生物标志物;4)整合研究结果,绘制多个器官系统异质性衰老的相互作用网络及其潜在的跨层分子调控机制。
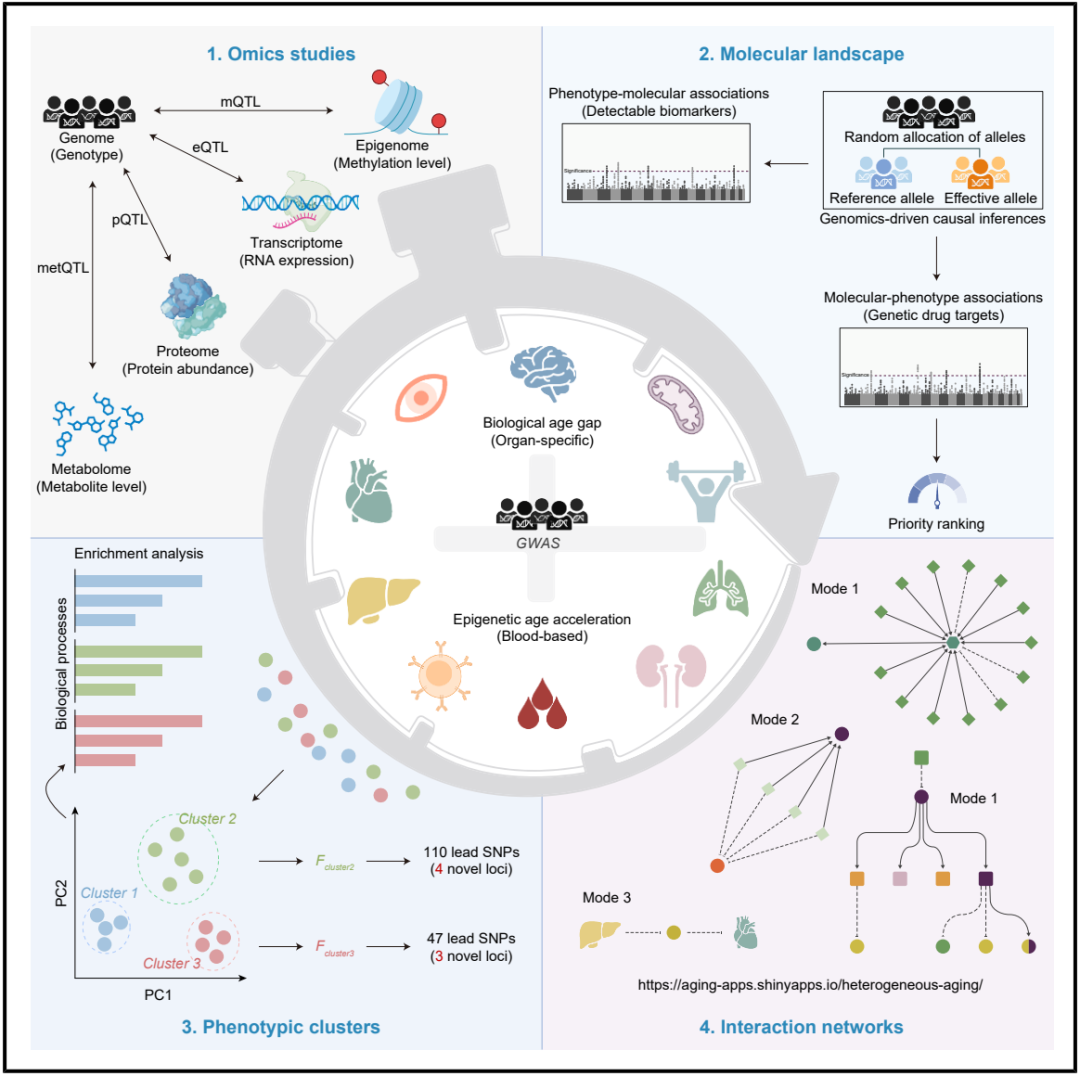
该研究的核心发现:
异质性衰老表型簇表现出不同的生物学特征;
基于基因组学的方法确定了异质性衰老的优先药物靶点;
下游蛋白质组学和代谢组学效应揭示了异质性衰老的生物标志物;
综合研究结果阐明了异质性衰老的跨层交互网络。
综合上述发现,研究团队开发了一个基于 R/Shiny 的框架,可通过https://aging-apps.shinyapps.io/heterogeneous-aging/ 公开获取,该框架提供了异质性衰老的全面多组学分子图谱,揭示了异质性衰老的多组学基础。
总的来说,这项研究推进了我们对衰老异质性的理解,为延缓器官特异性衰老以及预防或治疗相关慢性疾病的医疗策略提供了信息。有助于推动旨在延长健康寿命的创新治疗策略的开发。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
