中国科学技术大学最新Science论文:揭开神经信号传递中的“亲吻-收缩-逃逸”机制
时间:2025-10-21
来源:生物世界 2025-10-21 15:05
这一“亲吻-收缩-逃逸”机制,不仅统一了争议半个世纪的两种模型,同时提示了神经突触高效与高保真传递的结构基础,也为深入理解神经信号传递、突触可塑性以及相关脑疾病的机理提供了新视角。大脑功能的实现,依赖于神经元之间高效而精准的突触传递。当动作电位到达突触前终端时,突触囊泡释放神经递质实现信号的跨神经元传递。
20 世纪 50 年代,伯纳德 卡茨(Bernard Katz)提出了突触传递过程中神经递质的量子化释放假说,奠定了神经信息传递的细胞机制基础。至 1970 年代初,学界逐渐形成两种对立的突触囊泡释放模型:全融合(Full-collapse)和亲吻-逃逸(Kiss-and-run)。
然而,由于囊泡释放过程发生在毫秒时间尺度、结构变化处于纳米空间尺度,技术手段的局限,使得关于这两种模型的争议长期悬而未决,成为困扰神经科学领域半个世纪的难题。
2025 年10 月 17 日,中国科学技术大学/中国科学院深圳先进技术研究院脑认知与脑疾病研究所/深港脑科学创新研究院毕国强、刘北明、陶长路团队,联合加州大学洛杉矶分校周正洪团队,在国际顶尖学术期刊Science上发表了题为: Kiss-shrink-run unifies mechanisms for synaptic vesicle exocytosis and hyperfast recycling"的研究论文。
该研究通过自主研发的毫秒级时间分辨原位冷冻电镜成像技术,破解了神经信号传递过程中,突触囊泡释放与快速回收的生物物理过程 亲吻-收缩-逃逸/融合 (Kiss-Shrink-Run/Collapse)。这一成果统一了半个世纪以来关于突触囊泡释放与回收机制的两个争议模型,为理解神经信号传递、神经可塑性及相关脑疾病机理提供全新视角。

时间分辨冷冻电镜技术解析突触囊泡释放与回收动态过程
冷冻电镜断层成像技术(cryo-electron tomography, cryo-ET),能够对快速冷冻后近生理状态的细胞样品直接进行三维成像,已成为在细胞原位解析蛋白质等生物大分子结构及其三维空间分布的强有力工具。自 2010 年起,团队致力于将 cryo-ET 成像应用于神经突触的结构与功能研究,经过多年持续攻关,成功实现对原代培养神经细胞中完整突触的 cryo-ET 成像。进一步,得益于团队自主研发的三维重构软件IsoNet,研究人员清晰分辨出不同形态的突触囊泡;并首次在突触前区域,观测到一类直径约 29 纳米的 小囊泡 (正常突触囊泡直径在42纳米左右),推测其为囊泡释放的中间状态。
为验证这一猜测,并进一步实现对突触囊泡释放动态过程的精准解析,研究团队将光遗传学刺激与投入式冷冻技术进行耦合,开发出毫秒级时间分辨的冷冻电镜制样技术。具体实验中,在神经元中表达光敏蛋白,利用光刺激精准诱发动作电位,随后在不同时间间隔(4 300 毫秒)对细胞进行快速冷冻固定,从而捕捉囊泡释放的瞬时状态。基于此方法,团队获取了上千套高分辨率的神经突触三维重构数据。
随后,研究团队利用cryo-ET 子断层三维平均技术(Sub-tomogram average),对不同状态的囊泡进行三维平均。在三维平均图像中,可以清晰分辨出囊泡与细胞膜的半融合结构、囊泡与细胞膜形成的狭小融合孔、以及介导囊泡融合的蛋白复合物,进一步明确了这些囊泡是处于释放的中间状态。另一方面,研究人员通过对上千套突触数据的统计分析,发现了不同形态囊泡的数量随时间的动态变化。
基于上述结果,研究团队绘制出突触囊泡释放与快速回收的完整过程,并提出全新理论模型:囊泡在动作电位触发后4 毫秒内,先与突触前膜融合形成~4 纳米的融合孔( 亲吻 ,kiss),随后收缩成表面积为原来一半的小囊泡( 收缩 ,shrink),最后,大部分小囊泡在 70 毫秒内开始以 逃逸 (Run)方式回收,少部分则与突触前膜 全融合 (Collapse)。
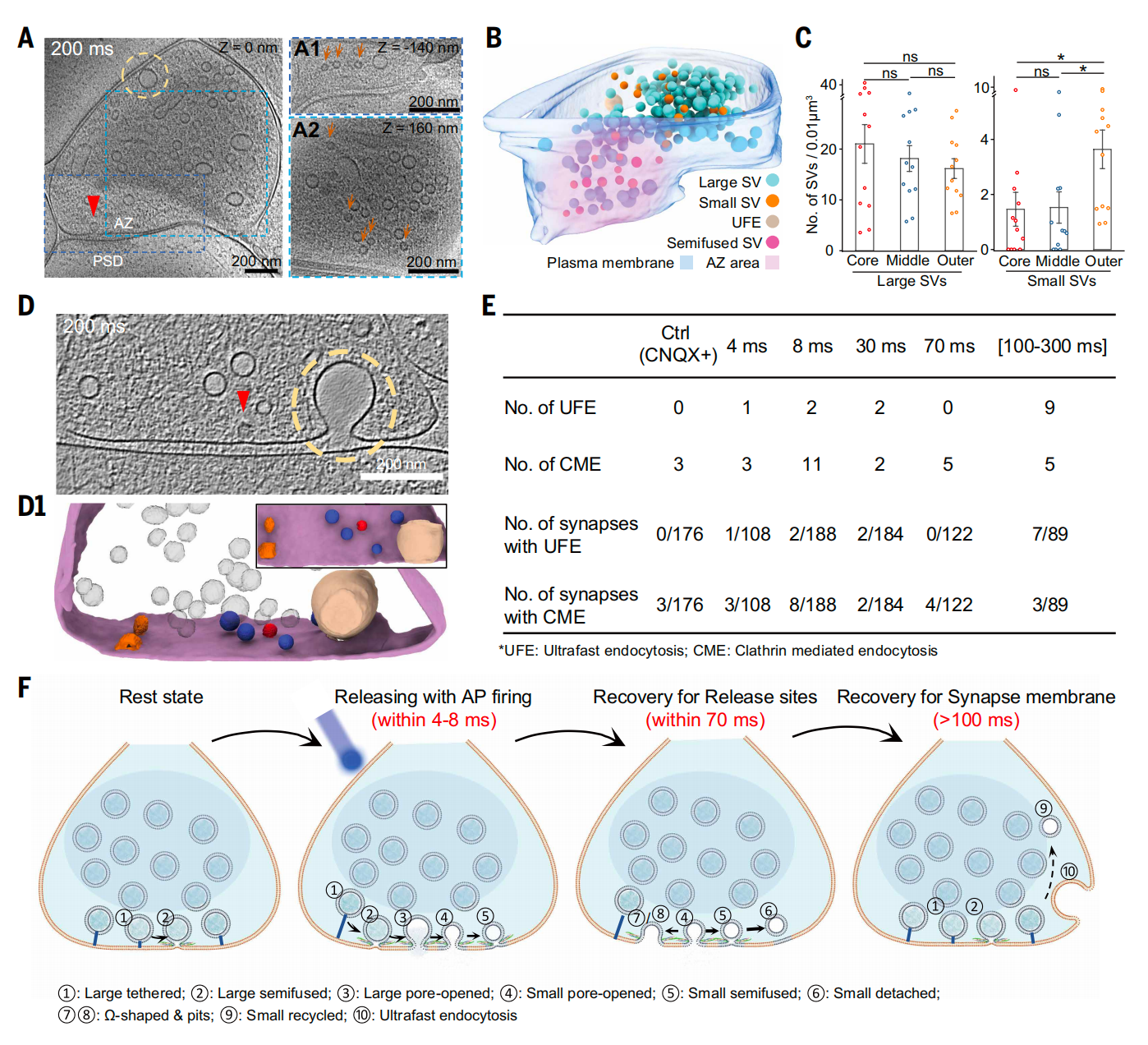
突触囊泡释放与快速回收
这一研究更新了传统认知:囊泡释放并非简单的全融合或亲吻-逃逸,而是包含一个关键的中间收缩阶段。这一 亲吻-收缩-逃逸 机制,不仅统一了争议半个世纪的两种模型,同时提示了神经突触高效与高保真传递的结构基础,也为深入理解神经信号传递、突触可塑性以及相关脑疾病的机理提供了新视角。相关创新技术对研究细胞内其他动态过程也具有应用价值。
陶长路、田崇礼、刘云涛、卢振航为该论文共同第一作者;毕国强教授、刘北明教授、陶长路特任副研究员、周正洪教授为论文共同通讯作者。
相关阅读:
2025 年 7 月 10 日,毕国强教授、刘北明教授团队等,在国际顶尖学术期刊Cell上发表了题为:High-speed mapping of whole-mouse peripheral nerves at subcellular resolution的研究论文。
该研究首创了一套超高速小鼠全身亚细胞分辨率三维成像技术 blockface-VISoR,成功实现了对全身神经系统的高分辨率三维重建,并绘制了前所未有的精细外周神经图谱,将连接组学成功拓展至大脑之外,为解析周围神经调控网络及疾病机理研究提供了全新工具。

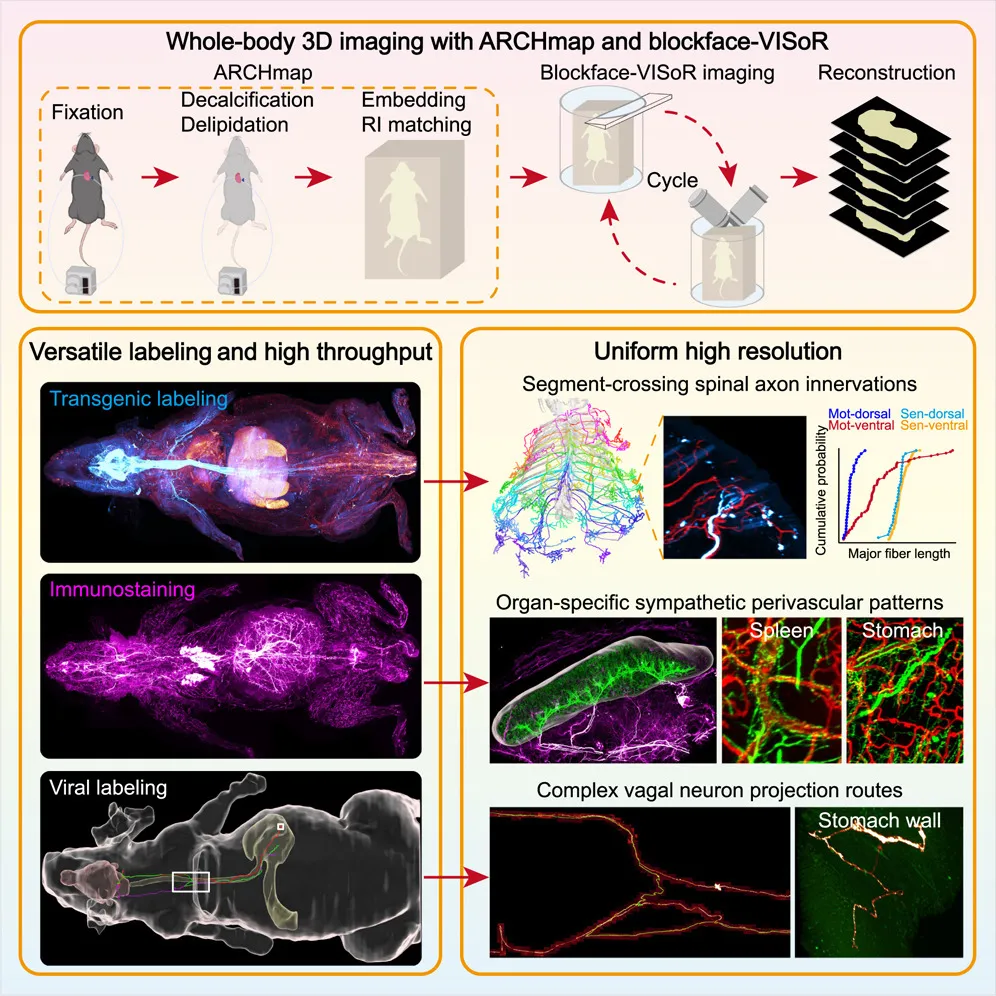
值得一提的是,国际顶尖学术期刊Nature在其官网头条报道了这项研究,指出这项研究详尽展示了小鼠的全身神经,让我们看到了令人惊叹的高分辨率图像。

论文链接:
https://www.science.org/doi/10.1126/science.ads7954
https://www.cell.com/cell/fulltext/S0092-8674(25)00673-7
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
