Nature:杏仁核—肝脏信号通路协调应激时的血糖反应
时间:2025-09-21
来源:brainnews 2025-09-21 14:37
本研究发现,投射至MeA神经元在调控身体和社交压力引发的高血糖反应中起关键作用。面对环境威胁时,生物体需要做出行为适应以确保生存,这一过程依赖于能量储备的快速调动。杏仁核在协调应对威胁的行为反应中起着关键作用,但其在代谢适应中的作用尚不清楚。近日,西奈山伊坎医学院P. J. Kenny2 S. A. Stanley在Nature发表相关研究论文。本研究发现,急性应激会激活投射至腹内侧下丘脑(MeAVMH神经元)的内侧杏仁核神经元,进而引发高血糖和进食减少。MeAVMH神经元对血糖的调控作用不依赖于肾上腺或胰腺等经典的血糖调节激素。通过全身体内病毒示踪技术,作者发现了一条从内侧杏仁核到肝脏的多突触神经通路,该通路可促进肝脏糖异生,快速合成葡萄糖。反复的应激暴露会破坏内侧杏仁核对血糖的调控,导致类似糖尿病的糖稳态紊乱。该研究揭示了一条 杏仁核 肝脏 神经轴,它不仅介导机体对压力的快速血糖调节反应,也将反复应激与代谢功能障碍联系起来。

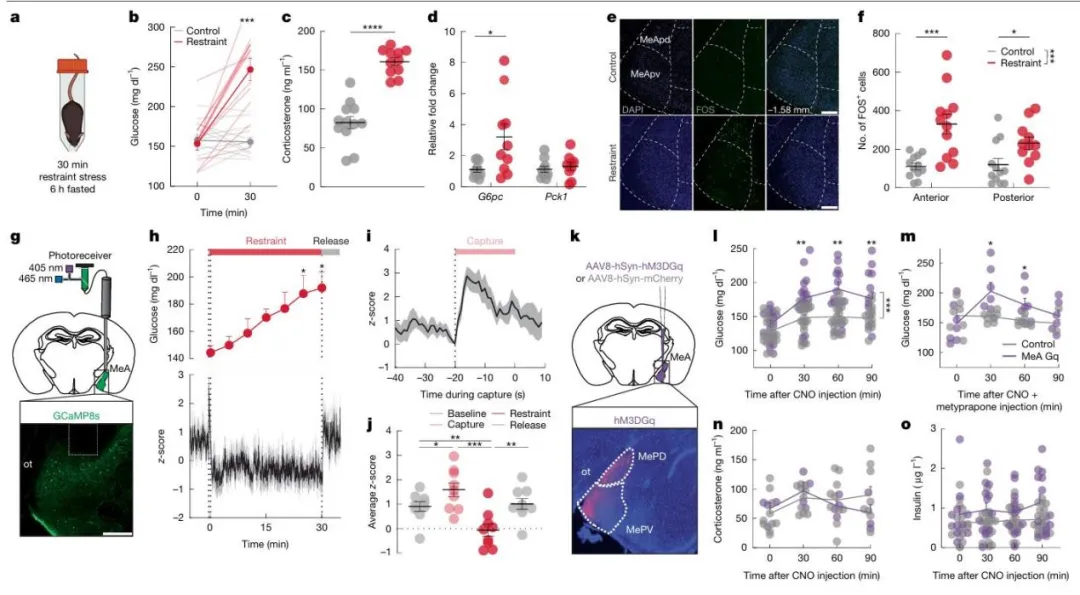
图1 压力激活内侧杏仁核神经元调控血糖
为探究应激相关代谢适应的中枢机制,研究首先在C57Bl/6小鼠中确认了多种急性应激源可显著升高血糖并抑制食欲。束缚应激能快速升高血糖、损害糖耐量,并激活HPA轴(皮质酮升高)和肾上腺髓质系统(肾上腺素、胰高血糖素和甘油升高),但对胰岛素和去甲肾上腺素无显著影响。在自由进食小鼠中,束缚应激同样升高血糖、皮质酮和胰高血糖素,同时降低胰岛素并上调肝脏葡萄糖-6-磷酸酶(G6pc)表达,提示肝脏糖生成能力增强。类似地,暴露于同种雄性小鼠气味引发的社会应激也能升高血糖、损害糖耐量,并抑制进食。即使是短暂(5分钟)的束缚或社会应激,也能迅速升高血糖和皮质酮。这些结果表明,无论是生理还是心理应激,均可快速激活全身性糖调节机制,驱动适应性代谢反应,为后续研究其神经调控通路提供了功能基础。
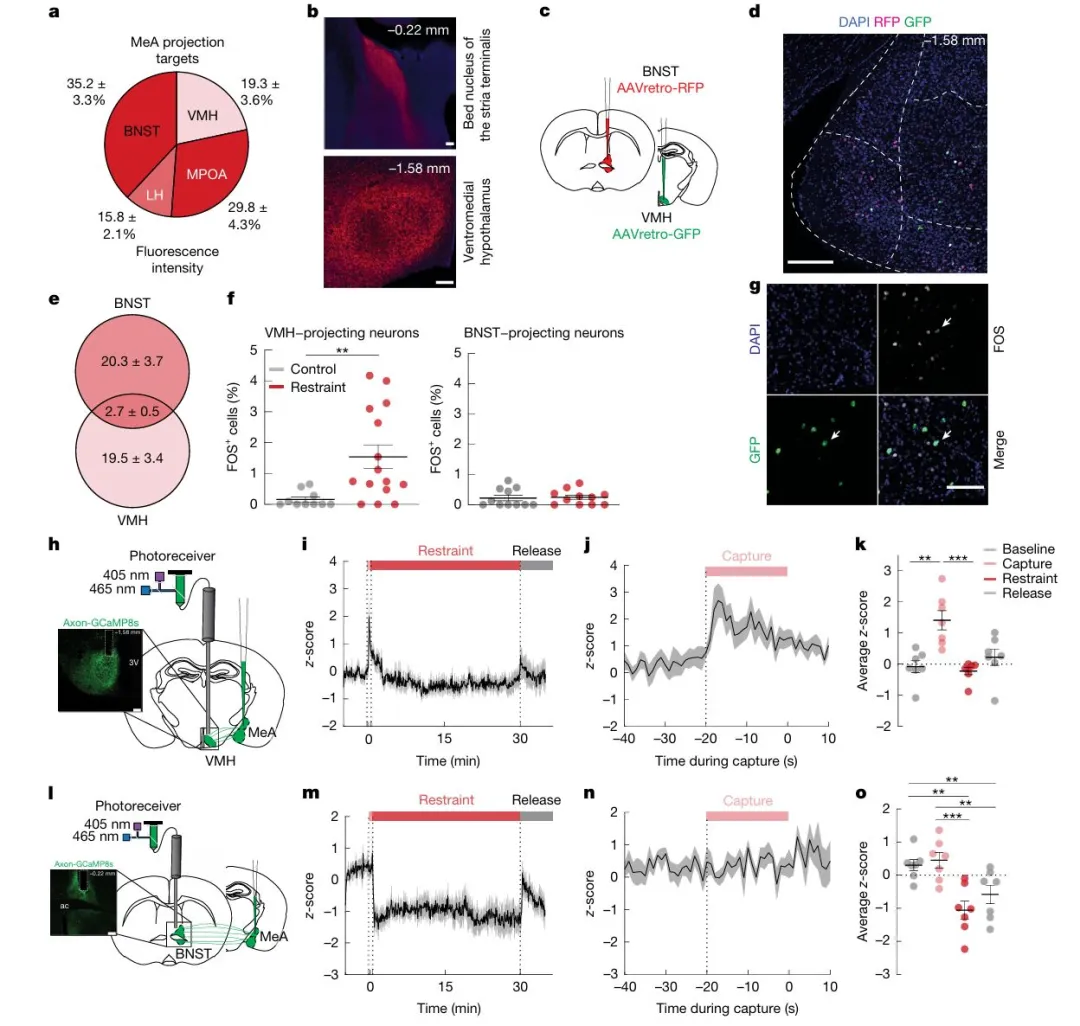
图2 急性束缚应激会选择性激活MeA VMH,而不会激活MeA BNST
接下来,作者研究了内侧杏仁核神经元调控血糖和食欲的神经环路机制。病毒示踪显示,这些神经元的轴突密集投射至多个调控代谢的下丘脑区域以及终纹床核。为探究投射至腹内侧下丘脑或终纹床核的神经元是否参与代谢调节,作者进行逆行标记,发现两群神经元基本不重叠。在束缚应激下,仅投射至腹内侧下丘脑的神经元被显著激活,表现为FOS表达增加。进一步通过活体钙成像发现,这类投射神经元在多种应激发生前即出现活性上升且早于血糖升高;而投射至终纹床核的神经元仅响应特定社会应激,在束缚等应激下无显著反应。综上,内侧杏仁核中存在功能分离的神经通路:投射至腹内侧下丘脑的神经元特异性响应多种应激,率先激活并驱动血糖升高,是应激性代谢反应的关键启动者。
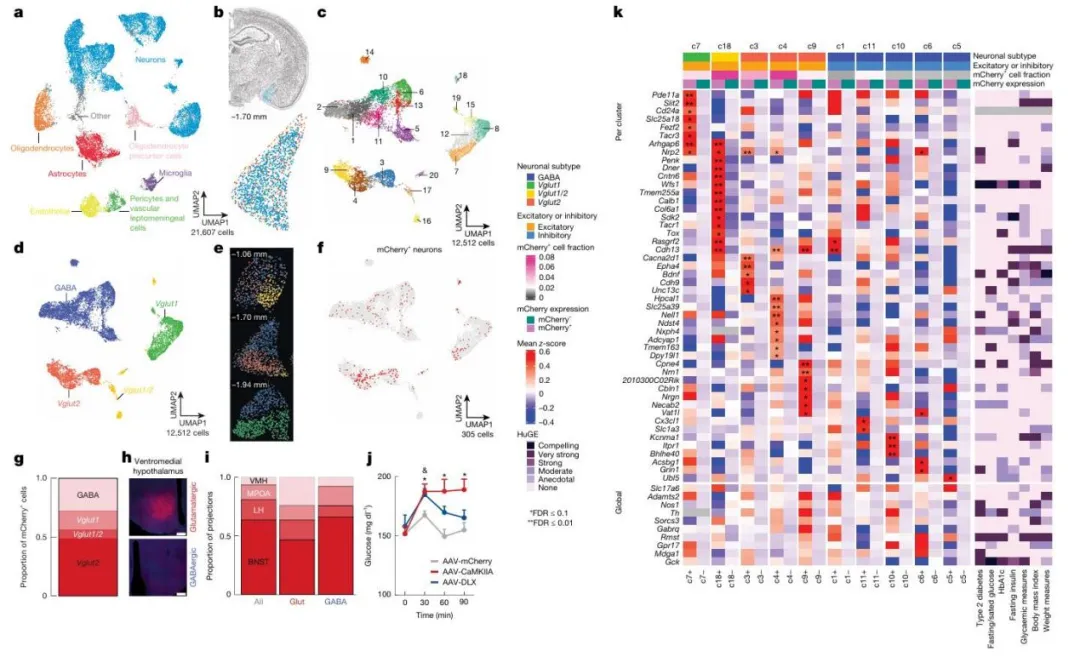 图3 内侧杏仁核至腹内侧下丘脑神经元的特异性基因表达谱
图3 内侧杏仁核至腹内侧下丘脑神经元的特异性基因表达谱
本研究通过空间转录组学和神经元特异性标记技术探究了内侧杏仁核(MeA)向腹内侧下丘脑(VMH)投射的神经元特征及其在血糖调控中的作用。首先,基于空间转录组数据的UMAP降维分析揭示了内侧杏仁核(MeA)细胞的聚类结构与细胞类型组成,并进一步解析了GABA能及谷氨酸能神经元(包括Vglut1+、Vglut2+以及Vglut1/2+亚群)在MeA内的分子特征分布及其空间定位模式。进一步分析显示,VMH投射的mCherry+ MeA神经元在不同亚型中的分布情况,揭示了谷氨酸能和GABA能神经元对VMH的不同投射强度。顺行示踪实验表明,MeA谷氨酸能神经元相较于GABA能神经元对VMH的突触前末梢标记物表达更高,证实了其作为主要输出通路的角色。此外,通过化学遗传学激活特定类型的MeA神经元观察到小鼠血糖水平的变化,证明了这两类神经元在血糖调节中的差异性贡献。通过对mCherry+和mCherry 细胞进行差异表达基因比较,识别出与血糖指数相关的重要基因,并利用人类遗传证据框架对其进行了评分,为理解MeA-VMH通路在代谢调控中的分子机制提供了新见解。
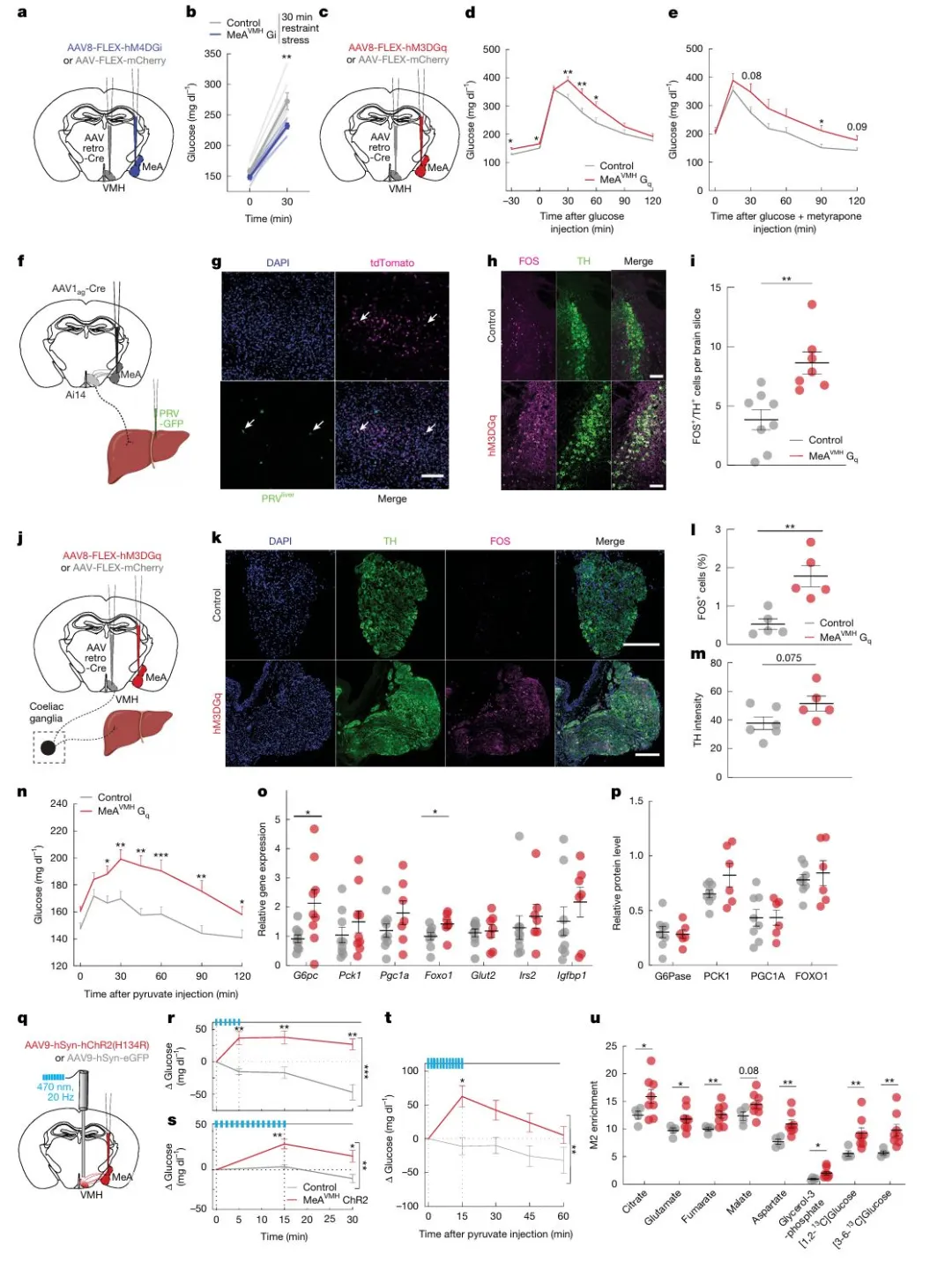
图4 MeAVMH神经元调控血糖稳态
研究通过多种神经调控和示踪技术证实,投射至VMH的内侧杏仁核神经元(MeA VMH)在调控血糖中起关键作用。化学遗传学沉默该通路可显著降低小鼠在束缚应激后的高血糖反应;而激活该通路则升高基础血糖,并促进葡萄糖生成,且这一效应不依赖于皮质酮等激素。病毒示踪结合荧光标记显示,MeA通过VMH与肝脏形成多突触连接,且部分VMH神经元同时接收MeA输入并投射至肝脏。功能实验发现,激活MeA VMH通路可增强蓝斑去甲肾上腺素能神经元及腹腔神经节酪氨酸羟化酶(TH)阳性交感神经元的活动(FOS表达增加),进而促进肝脏糖异生:表现为丙酮酸耐量试验中血糖升高、肝内糖异生基因(如Pck1、G6pc)和蛋白表达上调,以及稳定同位素标记的[2,3-13C]丙酮酸更多转化为葡萄糖代谢物(M2富集)。此外,光遗传学激活MeA VMH神经元可在5 15分钟内迅速升高血糖并增强糖异生反应。综上,这些结果揭示了一条从MeA到VMH再到肝脏的交感神经通路,能够快速驱动肝糖输出,是应激性高血糖的核心机制。
总结
本研究发现,投射至MeA神经元在调控身体和社交压力引发的高血糖反应中起关键作用。令人意外的是,这种调控不依赖于经典的肾上腺或胰腺血糖调节激素。MeA神经元通过交感神经系统形成多突触通路连接肝脏,促进肝糖异生,快速释放葡萄糖。反复压力暴露会导致这些调控肝脏的MeA神经元功能异常,引起血糖持续升高。若该机制在人类中同样存在,表明内侧杏仁核信号紊乱可能是长期压力诱发代谢疾病的重要原因。
原文链接:
https://doi.org/10.1038/s41586-025-09420-1
参考文献
Carty JRE, Devarakonda K, O Connor RM, Krek A, Espinoza D, Jimenez-Gonzalez M, Alvarsson A, Hampton RF, Li R, Qiu Y, Petri S, Shtekler A, Rajbhandari A, Conner K, Bayne M, Garibay D, Martin J, Lehmann V, Wang L, Beaumont K, Kurland I, Yuan GC, Kenny PJ, Stanley SA. Amygdala-liver signalling orchestrates glycaemic responses to stress. Nature. 2025 Sep 3. doi: 10.1038/s41586-025-09420-1. Epub ahead of print. PMID: 40903586.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
