谭蔚泓院士连发3篇论文,开发核酸适配体药物,治疗阿尔茨海默病及多种癌症类型
时间:2025-10-10
核酸适配体(Aptamer)是一类短的单链 DNA 或 RNA 寡核苷酸,通过形成三维空间结构,靶向结合特定蛋白或者细胞发挥作用,其具有广泛优点,包括高度特异性、易于合成、可定制、热稳定性好、分子小、组织穿透能力强等。成为选择性靶向特定蛋白质或细胞以治疗多种疾病类型的新选择。
近日,中国科学院杭州医学研究所谭蔚泓院士团队连续发表了 3 篇论文,开发了多款基于核酸适配体(Aptamer)的候选药物,在以及包括三阴性在内的多种癌症类型中显示出了有潜力的治疗效果。
Apt-M,治疗阿尔茨海默病
2025 年 10 月 1 日,中国科学院杭州医学研究所谭蔚泓院士、邱丽萍研究员团队在 Nature子刊Nature Biomedical Engineering上发表了题为:Targeted clearance of extracellular Tau using aptamer-armed monocytes alleviates neuroinflammation in mice with Alzheimer s disease的研究论文。
该研究开发了核酸适配体武装的单核细胞 Apt-M,能够靶向清除细胞外 Tau 蛋白,减轻了阿尔茨海默病小鼠模型的神经炎症,还能够改善其记忆和空间学习能力,且未引发毒性或行为方面的副作用。

研究团队开发了一种基于单核细胞的清除 Tau 蛋白的细胞疗法 Apt-M,该单核细胞通过高亲和力的 Tau 蛋白特异性核酸适配体进行了功能化修饰。Apt-M 治疗后,阿尔茨海默病小鼠模型的神经胶质细胞的激活受到抑制,神经炎症得到缓解,神经元和线粒体的完整性得以保持。长期治疗则改善了阿尔茨海默病小鼠模型的记忆和空间学习能力,且未引发毒性或行为方面的副作用。
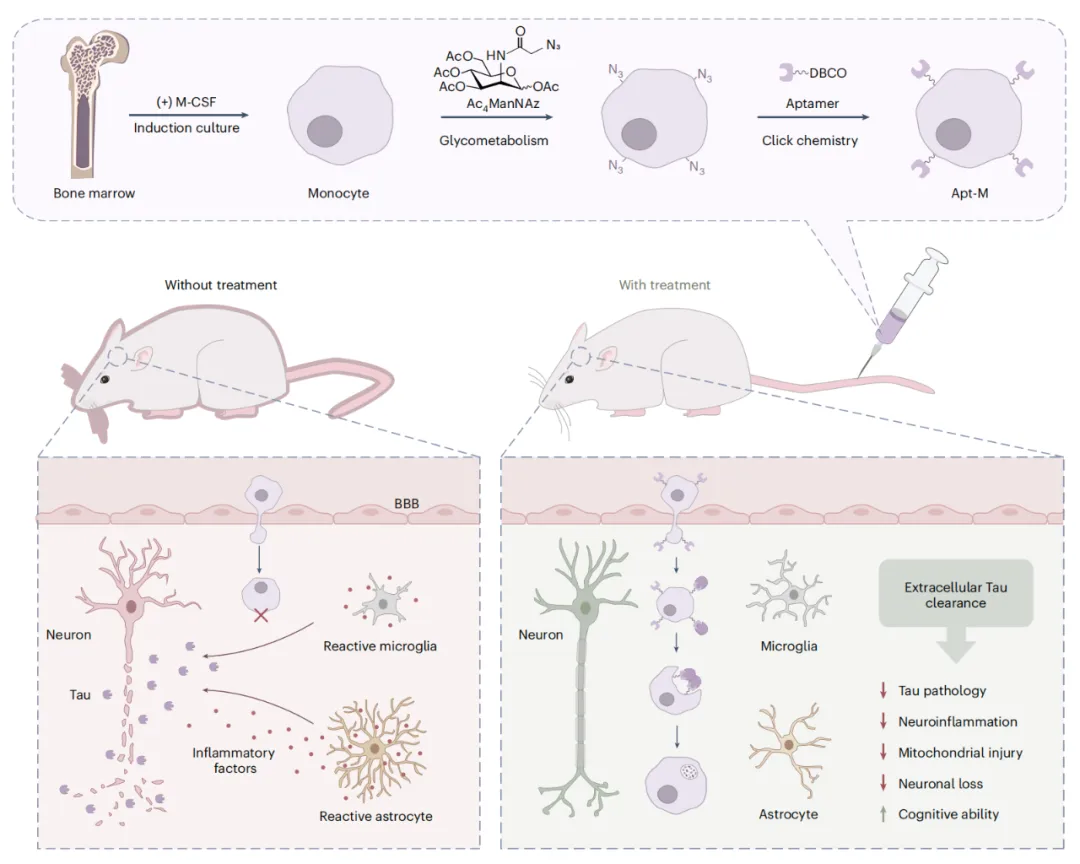
这项研究表明,核酸适配体(Aptamer)引导的单核细胞能够实现靶向递送、有效清除以及持续的神经保护,为阿尔茨海默病(AD)的治疗干预提供了一种很有前景的策略。
CD4 核酸适配体工程化细胞平台,治疗三阴性乳腺癌
2025 年 9 月 30 日,中国科学院杭州医学研究所/浙江省肿瘤医院谭蔚泓院士、吴芩研究员团队在 Cell 子刊Cell Biomaterials上发表了题为:CD4 aptamer-engineered cell platforms enhance anti-tumor immunity in triple-negative breast cancer的研究论文。
该研究开发了CD4 核酸适配体工程化液氮处理(AptCD4-LNT),能够选择性招募并激活 CD4+ T 细胞,在体内驱动 CD4+ T 细胞的特异性浸润和活化,还能增强 NK 细胞、B 细胞和树突状细胞的浸润和活性,重塑环境,强烈抑制三阴性乳腺癌(TNBC)肿瘤生长。

尽管 CD8+ T 细胞是主要的抗肿瘤效应细胞,但 CD4+ T 细胞也发挥着关键的辅助和直接杀伤作用,然而其临床应用却因肿瘤浸润不良以及免疫抑制性的肿瘤微环境(TME)而受阻。
为克服这一难题,研究团队研发了CD4 核酸适配体工程化液氮处理癌细胞(AptCD4-LNT),旨在选择性激活并招募 CD4+ T 细胞,以增强三阴性乳腺癌(TNBC)的抗反应。
该系统利用 CD4 核酸适配体对 CD4+ T 细胞的特异性靶向和氮处理癌细胞(LNT)的归巢能力,促使 CD4+ T 细胞在三阴性乳腺癌肿瘤微环境中实现靶向浸润和激活。活化的 CD4+ T 细胞反过来又能增强 NK 细胞、B 细胞和树突状细胞的浸润和活性,重塑免疫环境,增强抗肿瘤反应。
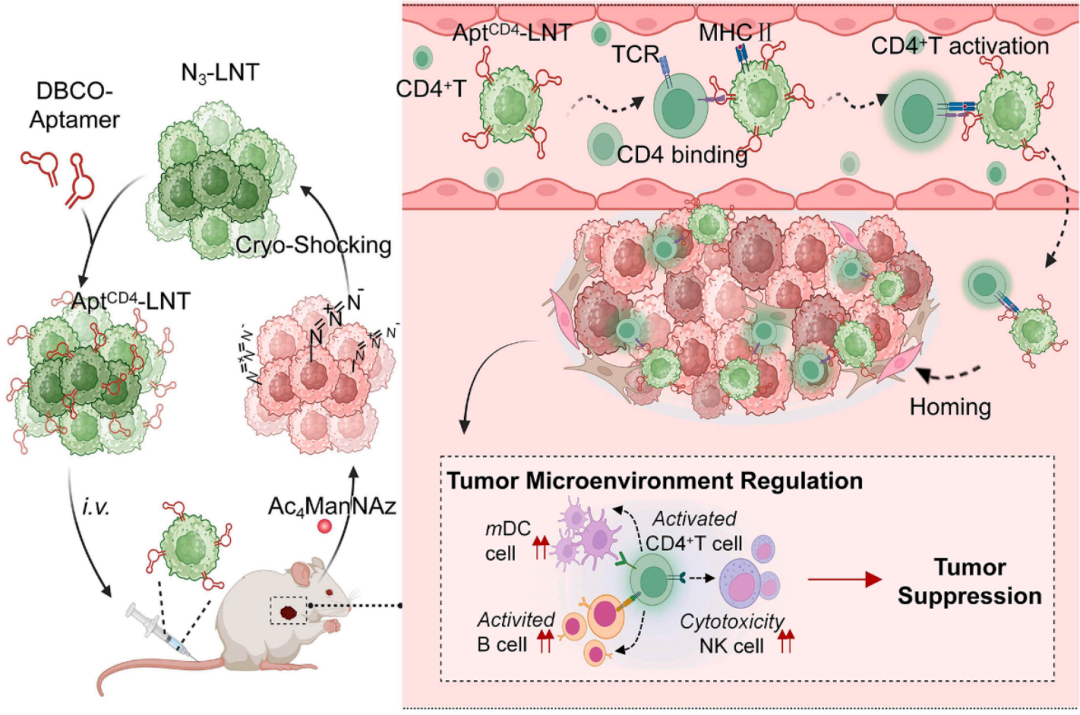
这项研究结果突显了 CD4+ T 细胞在三阴性乳腺癌免疫治疗中的关键作用,并为推进以 CD4 为靶点的治疗策略提供了前景广阔的新思路。
ApDC,治疗多种癌症类型
2025 年 9 月 24 日,中国科学院杭州医学研究所谭蔚泓院士、刘湘圣研究员、何嘉轩高级工程师等在Signal Transduction and Targeted Therapy期刊发表了题为:An aptamer-drug conjugate for promising cancer therapy with comprehensive evaluation from rodents to non-human primates的研究论文。
该研究开发了一种核酸适配体-药物偶联物(ApDC) Sgc8c-M,是由强效抗有丝分裂剂MMAE与经典的 PTK7 核酸适配体 Sgc8c 偶联而成,用于治疗PTK7 过表达的癌症,从啮齿类动物(小鼠、大鼠)到非人灵长类动物(食蟹猴)的全面评估结果显示,Sgc8c-M是一种充满希望癌症治疗药物。

核酸适配体(aptamer)作为独特的靶向配体,使得核酸适配体-药物偶联物(ApDC)成为靶向癌症治疗领域一种颇具吸引力的新策略。
在这项最新研究中,研究团队开发了一种靶向蛋白酪氨酸激酶-7(PTK7)的 ApDC Sgc8c-M,该ApDC 药物是通过将强效抗有丝分裂剂MMAE与经典的 PTK7 核酸适配体Sgc8c偶联而成。研究团队对其进行了从啮齿类动物到非人灵长类动物(NHP)的全面评估。
结果显示,Sgc8c-M 能够有效诱导细胞系来源的和患者来源的异种移植瘤模型产生持续的肿瘤消退,其效果优于未偶联的 MMAE、化疗药物紫杉醇,以及一种靶向 PTK7 的抗体药物偶联物(ADC)。且在食蟹猴猴中耐受性良好,多次给药后未见明显蓄积。
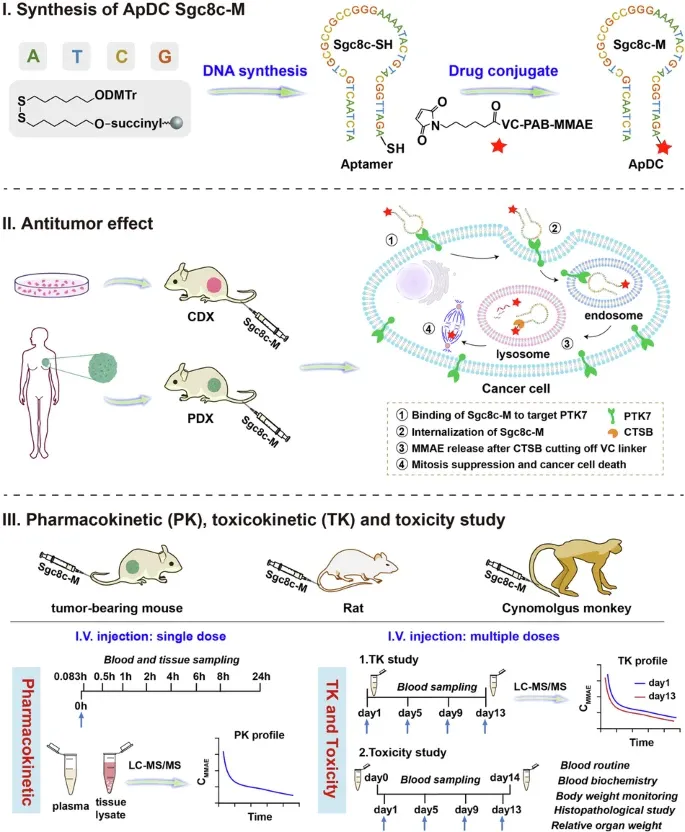
这项研究突显了 Sgc8c-M 作为一种有效抗肿瘤药物的潜力,并为新兴的 ApDC 的临床转化提供了有价值的见解。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
